炎症小体是先天免疫反应对抗病原体和死亡细胞等危险信号的关键组成部分。炎症小体活化导致caspase-1裂解活化,进而诱导细胞焦亡及促炎性细胞因子IL-1β和IL-18的产生。NLRP3炎症小体是目前研究最深入的炎症小体,其过度激活与自身免疫性疾病和炎性疾病有关。因此,NLRP3炎症小体的激活是被精确调控的,在此激活过程中,凋亡相关斑点样蛋白ASC的寡聚是一个必不可少的过程, 其寡聚是由翻译后修饰调控的,包括泛素化、去泛素化和磷酸化。是否有其他机制控制ASC寡聚并防止NLRP3炎症小体过度激活目前尚不清楚。
2021年8月3日,中国科学技术大学白丽教授课题组在Journal of Experimental Medicine (JEM) 发表题为“ASC deglutathionylation is a checkpoint for NLRP3 inflammasome activation”的研究论文,揭示了ASC谷胱甘肽化修饰能够抑制NLRP3炎症小体的激活,而谷胱甘肽转移酶GSTO1促进ASC发生去谷胱甘肽化,这一作用机制是NLRP3炎症小体活化的关键检查点。
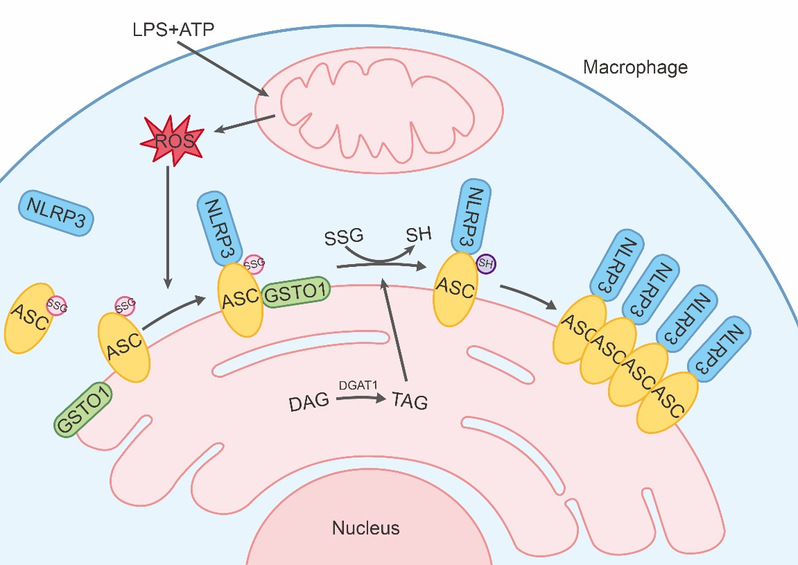
NLRP3炎症小体的激活受到精细调控以避免过度激活。虽然已经发现有多个调控NLRP3炎症小体激活的分子,但调控NLRP3炎症小体激活的检查点仍不明确。该项研究发现NLRP3炎症小体的激活是由巨噬细胞中谷胱甘肽转移酶GSTO1促进的ASC去谷胱甘肽化调控的。ASC谷胱甘肽化抑制ASC寡聚,从而抑制巨噬细胞中NLRP3炎症小体的激活。GSTO1与ASC蛋白结合并调控其去谷胱甘肽化发生在内质网上,并受线粒体ROS和甘油三酯合成的调控。在表达ASCC171A(缺陷谷胱甘肽化修饰位点的突变型ASC)的巨噬细胞中,NLRP3炎症小体的激活不依赖于GSTO1和ROS。此外,AscC171A小鼠在体内表现出NLRP3依赖的过度炎症反应。该项研究结果表明,ASC谷胱甘肽化抑制NLRP3炎症小体的激活,而GSTO1促进内质网上的ASC去谷胱甘肽化,在代谢控制下,是激活NLRP3炎症小体的一个检查点。
中国科学技术大学博士研究生李叔航为该文章的第一作者,白丽教授为通讯作者。该项研究工作获得了国家自然科学基金委,科技部,中国科学技术大学的大力支持。
文章链接:https://doi.org/10.1084/jem.20202637
