10月10-15日我校细胞动力学教育部重点实验室张凯铭团队在解析Lon蛋白酶的完整三维结构并揭示其底物识别与转移的分子机制取得重要进展,与台湾中央研究院张崇毅团队在期刊JBC和Sciences Advances合作连续发表论文。
Lon AAA+蛋白酶(LonA)是一种在原核生物和真核生物细胞器中保守的ATP依赖性蛋白酶。LonA组装为同源六聚体,每个单体都包含一个N端结构域、一个中间ATP酶结构域和一个C端蛋白酶结构域。LonA通过降解受损或错误折叠的异常蛋白质在细胞蛋白质稳态中发挥重要作用,从而防止这些不需要的蛋白质种类形成有毒聚集体。LonA还通过降解特定的调节蛋白来调控多种生物过程。
前人的研究揭示了LonA的多种功能和结构特征。具有开放活性位点构象的Lon蛋白酶域采用六重对称结构,而具有非活性蛋白水解位点构象的LonA则采用开放螺旋六聚体结构。ADP结合的LonA六聚体的晶体结构揭示了ADP如何通过诱导形成封闭的降解室来抑制LonA活性。通过假设来自两对三个非相邻单体的无核苷酸和ADP结合状态之间的结构转换,建立了基于ADP结合结构底物易位模型。然而最近的底物结合AAA+蛋白的冷冻电镜结构不支持上述简单的一步转换模型,认为其ATP酶结构域围绕中心定位的底物多肽链以螺旋梯状排列,包括最近人源和鼠疫耶尔森氏菌Lon蛋白酶的冷冻电镜结构均支持持续性旋转机制。但在这些工作中,用于重构的细菌Lon是一个Walker-B突变体;而人源Lon的结构则显示了不同的底物结合方式和核苷酸结合状态,表明Lon可能存在复杂的底物转移机制。
10月10日,张凯铭和张崇毅团队合作在期刊JBC发表题为“Molecular basis for the ATPase-powered substrate translocation by the Lon AAA+ protease”的文章。张凯铭课题组李珊珊等解析了Meiothermus taiwanensis Lon底物结合状态的3.6-Å冷冻电镜结构,发现ATPase结构域的双孔环介导底物相互作用,由处于不同ATP结合和水解状态的四个连续单体以螺旋梯状排列,揭示了其通过LonA特异性变构实现持续性旋转易位的分子机制。
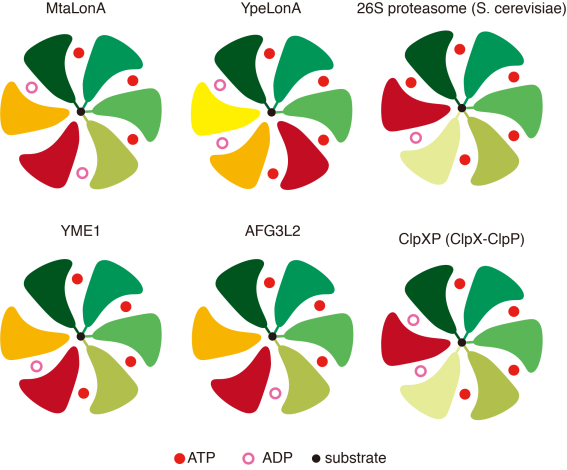
AAA+蛋白酶与底物结合的核苷酸结合状态比较
顶部视图显示了核苷酸和底物的结合状态。与底物结合的原体呈不同深浅的绿色。
然而到目前为止,Lon六聚体的现有报道的所有结构中没有包含N端区域,Lon如何选择蛋白质靶标作为底物、控制底物进入AAA+结构域、并介导底物去折叠的机制尚不清楚。
10月15日,合作团队在期刊Sciences Advances继续发表题为“Complete three-dimensional structures of the Lon protease translocating a protein substrate”的延续性工作。张凯铭课题组李珊珊等利用冷冻电镜进一步解析了Meiothermus taiwanensis Lon底物结合状态的完整三维结构,分辨率达2.4 Å。这些结构显示了一个具有张拉整体三角形复合体的多层结构,独特地由六个长N端螺旋构成。相互锁定的螺旋三角形组装在六聚体核心的顶部,以展开一个由六个球状底物结合域组成的网。它作为一个多用途平台,控制底物进入AAA+环、提供基于标尺的底物选择机制、并充当滑轮装置以促进AAA+环将ATP驱动的构象变化转化为机械力来推动易位底物的展开。该研究成果为理解Lon和其他具有类似活性的AAA+蛋白酶的结构机制提供了一个完整的框架。
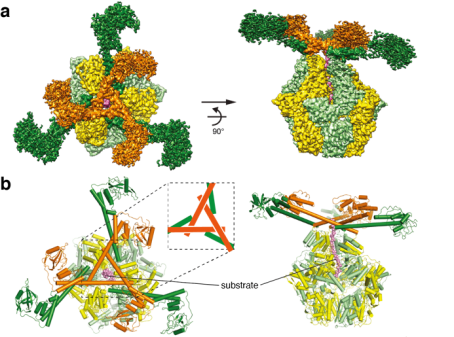
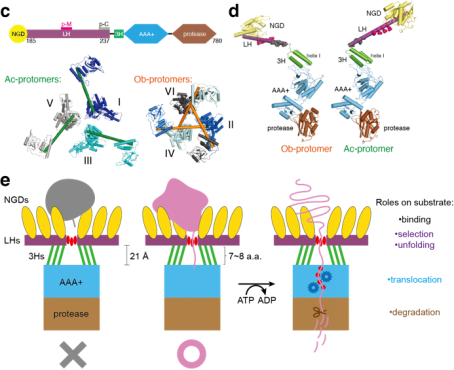
全长Lon的冷冻电镜结构解析。a.冷冻电镜结构。b.三维原子模型。c,d.二类单体的结构及结构域示意图。e.作用机制示意图。
斯坦福大学Wah Chiu院士为此工作提供了宝贵意见。本研究获得了Stanford-SLAC电镜平台、台湾中央研究院电镜平台和中国科学技术大学细胞动力学教育部重点实验室及冷冻电镜平台的大力支持。中国科学技术大学为第一完成单位,生命科学与医学部李珊珊副研究员为第一作者,张凯铭、张崇毅研究员为共同通讯作者。
Sciences Advanceslink:https://www.science.org/doi/10.1126/sciadv.abj7835
JBClink (扫描下方二维码打开)

(细胞动力学教育部重点实验室、合肥微尺度物质科学国家研究中心、中国科大生医部、科研部)
