中国科学技术大学王雪娟教授和蔡刚教授课题组,利用单颗粒冷冻电镜技术解析了酿酒酵母细胞内源性激活ATR激酶的结构,揭示了该激酶的活化新机制。研究成果以“Structures of Mec1/ATR Kinase Endogenously Stimulated by Different Genotoxins” 为题于9月29日在线发表在《Cell Discovery》杂志上。
基因组稳定性维持是一切生命活动的基础。 ATR作为细胞中DNA损伤修复通路当中的顶端激酶,负责启动细胞对基因组不稳定的响应和修复,一旦感应到DNA损伤和复制压力会迅速活化,直接磷酸化细胞内超过1000个重要底物(包括抑癌基因p53编码蛋白、细胞周期调控蛋白等),全局性地调控基因组的稳定。ATR及其参与的信号通路对基因组稳定,肿瘤的发生、发展和治疗至关重要。
前期工作中,蔡刚课题组报道了ATR激酶首个高分辨率冷冻电镜结构,发现并命名几个关键调控结构域、阐明其作用机理,提出了ATR激酶严谨调控的分子机制模型(Science, 2017)。近期,王雪娟教授与蔡刚教授课题组合作解析了通过诱导DNA损伤内源性活化的ATR激酶的结构,不仅验证了之前提出的机制模型,还发现了ATR激酶活化的新机制。
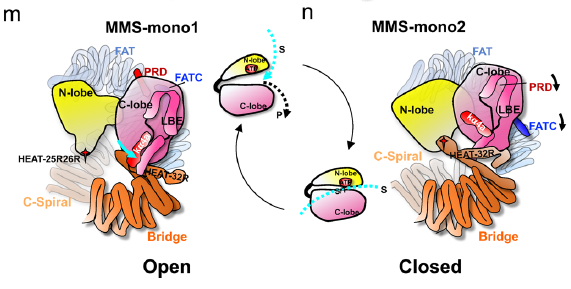
王雪娟教授和蔡刚教授课题组通力合作,分别利用HU和MMS两种基因毒素来诱导细胞,获得了DNA复制压力和DNA双链断裂压力活化的ATR激酶的冷冻电镜结构,揭示了ATR激酶采取对称活化和不对称活化-两种不同的激活模式;发现高度动态的N端-螺线管为激酶催化中心的N-lobe提供了两个备选的锚定位点,使其处在打开活性中心(方便底物结合或产物释放)和形成密闭催化腔室(促进磷酸根从ATP的γ位转移到底物蛋白)的两种构象状态。该研究成果揭示ATR响应不同DNA损伤的迥异的活化方式,发现ATR庞大的N端-螺线管调控活性中心构象的门控新机制,有望为新型ATR激酶高特异性抑制剂的设计提供关键靶点。
王雪娟课题组的博士研究生张庆军为文章第一作者。 该研究得到了中科院B类先导专项、自然科学基金委、科大新医学以及安徽省杰青项目的资助。
撰稿人:张庆军
原文链接:https://www.nature.com/articles/s41421-022-00461-8
