中国科学技术大学许超教授课题组解析了METTL9与底物、产物小肽的多个复合物晶体结构,揭示了METTL9识别并催化底物组氨酸N1甲基化的结构基础。研究成果以“Molecular basis for METTL9-mediated N1-histidine methylation”为题于4月4日在线发表在《Cell Discovery》杂志上。
甲基化是最丰富和最常见的翻译后修饰(PTM)之一,广泛参与细胞中重要的生物学过程。组氨酸甲基化发生在咪唑环的N1或N3位置,约占蛋白质甲基化修饰的13%。前期工作中,许超课题组鉴定SETD3作为哺乳动物中的组氨酸甲基转移酶,并催化actin第73位组氨酸N3甲基化。与SETD3不同,METTL9是哺乳动物细胞中的组氨酸N1位甲基转移酶,特异识别具有“x-His-x-His”序列(His表示组氨酸,x表示短链残基)的底物,并催化第二位组氨酸的甲基化。“xHxH”在金属结合蛋白中广泛存在,且组氨酸甲基化抑制金属蛋白质结合金属离子的能力。METTL9在多种恶性肿瘤中高表达,其致癌机理可能与其催化组氨酸甲基化调控细胞内金属离子浓度平衡有关。尽管METTL9具有重要生物学功能,但其底物识别和甲基化的分子机制在很大程度上是未知的。
研究人员首先在METTL9野生型引入6个突变以获得稳定并高度均一的METTL9突变体(METTL9M6),并解析了METTL9M6分别与两种小肽底物和一种甲基化小肽产物的复合物的晶体结构。结构分析表明METTL9通过保守的模式识别SLC39A5与mS100A9等底物中的“-3GHSH1”序列。底物组氨酸(H1)与其上游组氨酸(H-2)分别插入METLL9表面的两个组氨酸特异性口袋中,与周围的残基形成特异性的氢键和堆积相互作用;其中H1结合在催化口袋,其N1位氮原子靠近辅因子SAM以实现N1位特异的去质子化与甲基转移;其上游丝氨酸(S-1)结合在一个较小的口袋中,通过氢键与METTL9M6相互作用;上游甘氨酸(G-3)与METTL9M6之间形成氢键与堆积作用。由于-3位和-1位受到周围氨基酸残基空间位阻的影响,无法容纳大侧链的氨基酸残基。上述序列特异性相互作用完美解释了METTL9对“xHxH”基序的偏好性。
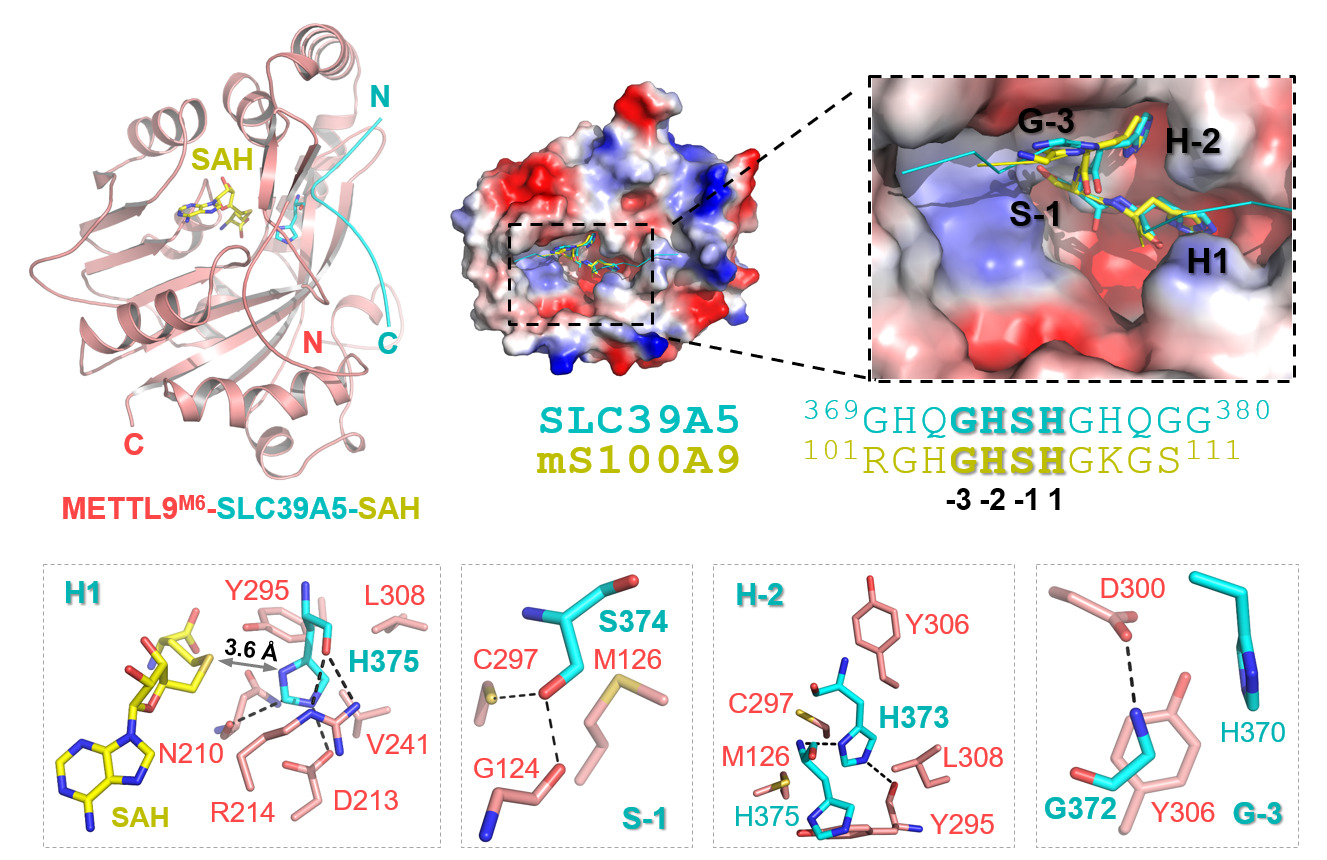
图:METTL9介导的底物识别和催化
研究人员进一步通过突变、等温滴定量热(ITC)、酶活等实验测量了METTL9M6的酶催化动力学参数,并验证了METTL9与底物之间的相互作用界面。该研究不仅解析了METTL9催化组氨酸N1甲基化的化学机制,还为未来设计METTL9的小分子抑制剂开发抗肿瘤药物提供了结构基础。
许超教授课题组的博士研究生王小洋(已毕业)与谢华彬为该论文的共同第一作者。许超教授为论文的通讯作者。该工作得到细胞动力学教育部重点实验室和微尺度国家研究中心的大力支持,以及科技部、国家自然科学基金等项目资助。中国科大姚雪彪教授、潘文教授、朱中良副教授、张家海工程师为该工作的顺利开展提供了巨大支持。
原文链接:https://www.nature.com/articles/s41421-023-00548-w
