磷脂酰胆碱(PC)和磷脂酰乙醇胺(PE)是真核生物膜的两种主要成分,在维持膜的完整性、脂滴的发生、自噬体形成等生理过程中发挥着重要作用。在大多数哺乳动物细胞中,PC和PE主要通过Kennedy途径合成,其最后一步反应由胆碱/乙醇胺磷酸转移酶催化,包括胆碱/乙醇胺磷酸转移酶1(CEPT1)、胆碱磷酸转移酶1(CPT1)和乙醇胺磷酸转移酶1(EPT1)。
我院钱洪武教授课题组,利用单颗粒冷冻电镜技术解析了人源CEPT1及其与底物CDP-胆碱复合物的三维结构,并借助一系列生化实验阐释了CEPT1识别底物及催化反应的分子机制。相关成果以“Structural basis for catalysis of human choline/ethanolamine phosphotransferase 1”为题于2023年5月3日在线发表在《Nature Communications》上。
研究者首先解析了CEPT1的冷冻电镜结构,并发现一个与催化腔连通的疏水空腔。空腔中发现了一个脂质分子的电子密度,研究者推测是内源结合的PC分子。将PC分子放进该密度后发现,PC的疏水尾部位于疏水腔,而极性头部正好处在催化位点附近(图1a)。这一结构信息表明疏水腔可能在催化过程中起到稳定脂质疏水尾巴的作用。同时,研究者也构建了基于高效液相色谱(HPLC)的酶活性检测实验,对该结构信息进行了验证。
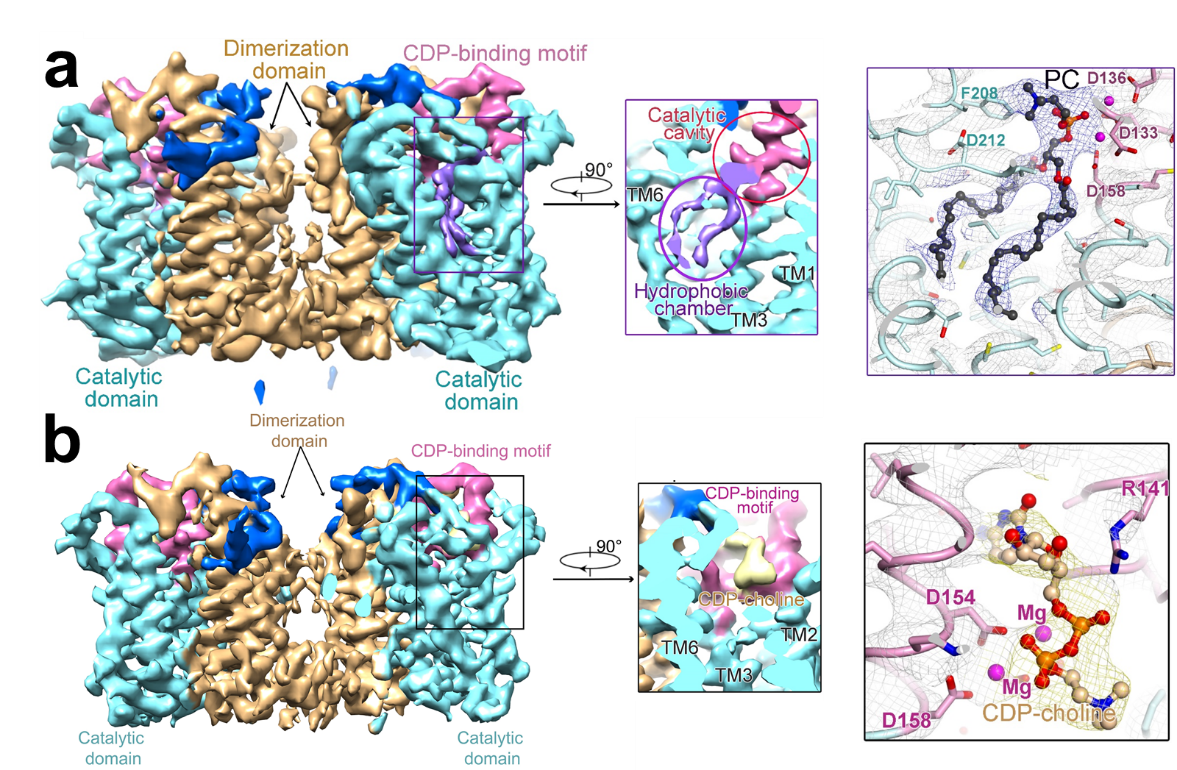
随后,该团队在冷冻样品制备前加入底物CDP-胆碱,得到了CEPT1与CDP-胆碱的复合物结构。结果发现,在这一复合物结构中,上述PC分子的电子密度消失了(图1b)。这暗示着底物CDP-胆碱的加入可能触发产物PC分子的释放。
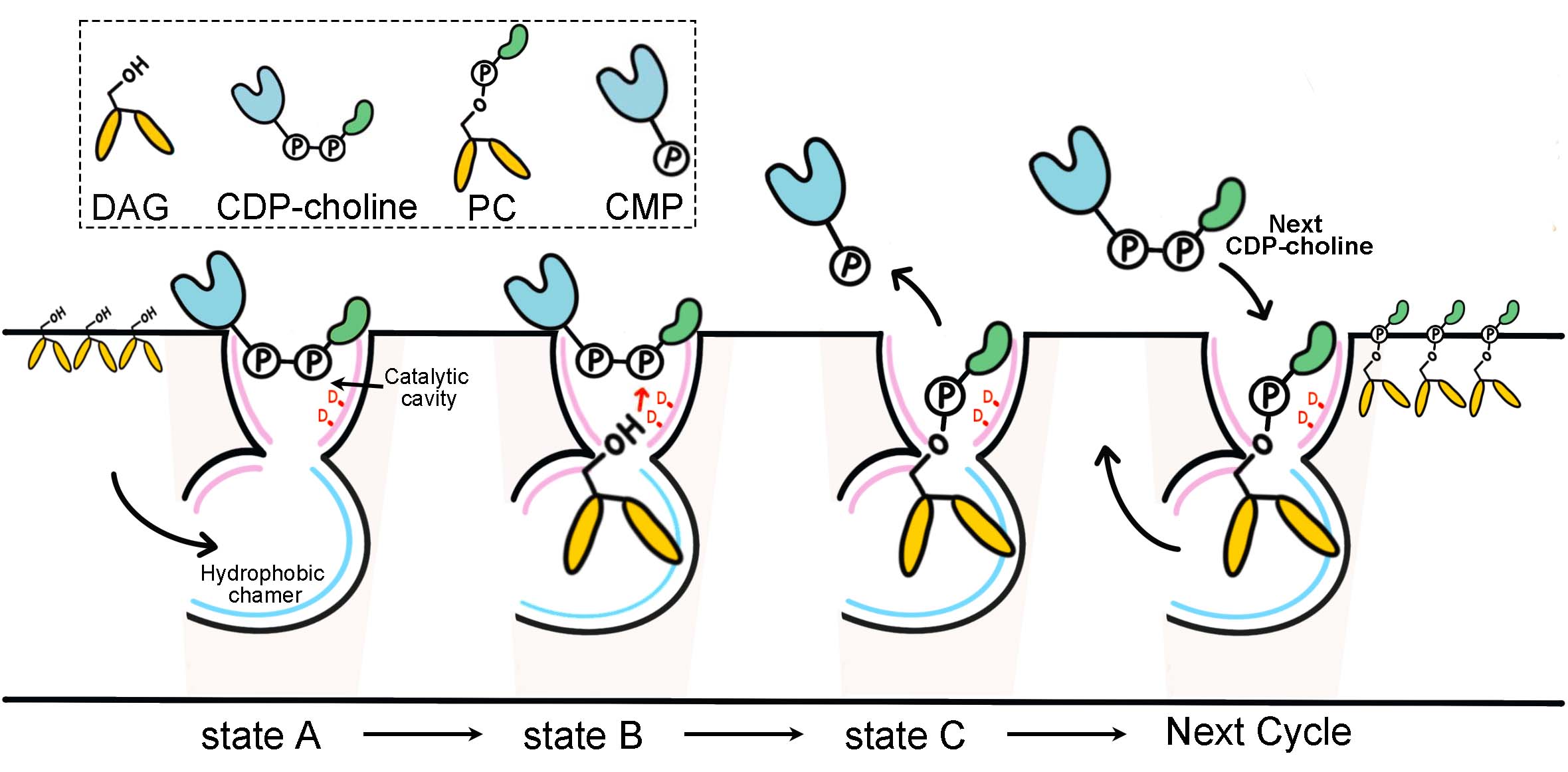
基于上述实验结果,研究者提出了如下催化模型:CDP -胆碱从细胞质中进入催化腔(state A);另一个底物DAG从细胞膜进入疏水空腔,使得亲水头部正好位于催化腔中(state B);反应结束后,产物CMP从胞质侧离开,而另一个产物PC则停留在催化腔中(state C);最后,新的底物CDP -胆碱分子进入促进催化腔中产物PC释放,从而进入下一个催化周期(图2)。
钱洪武教授为该论文的通讯作者,该课题组博士后王振华、博士生杨濛和硕士生杨宇凡为论文共同第一作者。冷冻电镜数据收集工作在中国科学技术大学冷冻电镜中心完成。该研究得到了基金委面上项目、中科大科研启动经费和生物医学与健康安徽省实验室学科人才引进基金项目等资助。
原文链接:https://www.nature.com/articles/s41467-023-38290-2
