近年来,伴随着癌症免疫治疗领域诸多进展的涌出,免疫检查点,作为一类参与免疫系统负调控的免疫调节蛋白越来越引起人们的注意。针对免疫检查点分子的免疫检查点阻断已然成为癌症免疫治疗中最有前途的方法之一。然而部分患者对于免疫治疗并不能产生有效的反应,了解免疫治疗耐药的分子机制对于找到克服免疫治疗耐药的新策略至关重要。
有研究表明hMEX3B,一种RNA结合蛋白,是黑色素瘤对PD-1阻断免疫治疗耐药的重要调节因子。在一组接受抗PD-1检查点阻断治疗的黑色素瘤患者中,黑色素瘤细胞中hMEX3B的低表达与应答密切相关。hMEX3B的这种作用依赖于内源性HLA-A的表达,可以通过过表达外源性HLA-A来逆转。此外,hMEX3B通过结合HLA-A mRNA的3'UTR来降低HLA-A的水平。这说明抗原呈递是免疫检查点阻断耐药机制的关键途径,hMEX3B在该途径中发挥重要作用。尽管如此,hMEX3B如何结合HLA-A mRNA的3'UTR,如何调控HLA-A的表达,仍存在一些不明确的问题。
MEX-3家族蛋白在哺乳动物中,有4个mex-3家族基因编码4种同源蛋白(hMEX3A~hMEX3D)。所有四种hMEX-3蛋白都由N端两个串联KH结构域和C端一个典型的C3HC4型锌指结构域组成。为了阐明hMEX3B蛋白与HLA-A mRNA相互作用的分子机制,研究人员首先在HLA-A mRNA的3’UTR的序列中筛选出了与hMEX3B具有高亲和力的RNA片段,并通过一系列生化实验证明了相较于单独的KH1和KH2结构域而言, 串联的两个KH结构域(KH1/2)与底物RNA的亲和力提高了100倍以上,说明了串联的KH结构域对于特异性的识别底物RNA是充分且必要的。
接下来,研究人员对复合物中单个KH结构域及其对应的底物RNA进行了结构研究。通过核磁主链指认和化学位移扰动实验,分别确定了KH1、KH2结构域和 KH1/2结构域识别底物RNA的关键残基。通过比较KH1、KH2结构域和 KH1/2结构域的扰动的化学位移,发现参与扰动的残基是极其相似的;唯一的区别是KH1/2结构域中的一些残基扰动得会更加剧烈。这一发现表明KH1/2结构域与12ntRNA的结合亲和力比KH1、KH2结构域与对应的6nt-RNA的结合亲和力要强得多,这与前面的亲和力实验结果相匹配。在此基础上,研究人员基于小角散射的实验数据,运用分子动力学模拟的方法搭建了hMEX3B与其底物RNA相互作用的结构模型(图1)。通过对结构的分析,研究人员发现,RNA结合于KH结构表面的正电荷沟槽中。而在这个沟槽中,两个氨基酸群(GxxG基序和一对TR)像手指一样钳住底物RNA,虽然其中的GxxG基序前人已经报道过了,但是这一组苏氨酸(T)和精氨酸(R)则是未曾报道过的。
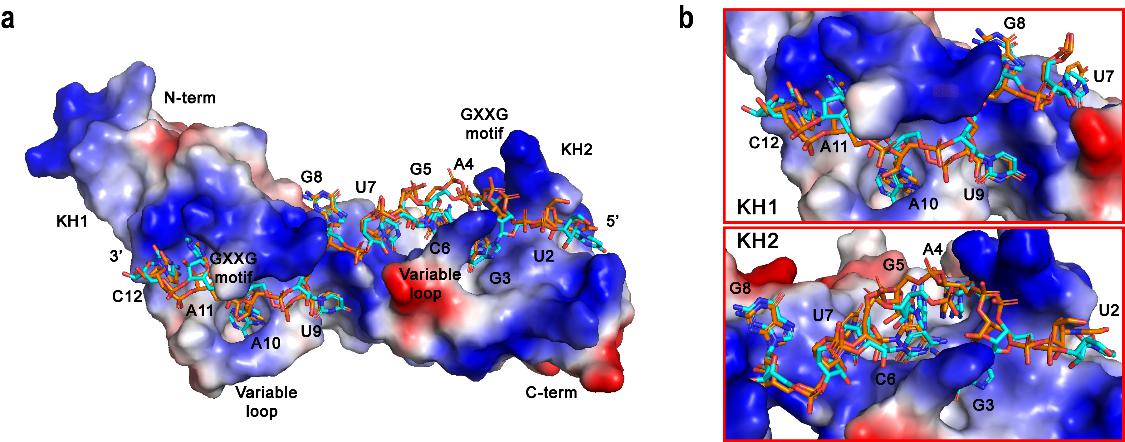
图1.hMEX3B蛋白质识别底物HLA-A mRNA的分子机制
同时,研究人员通过检测肿瘤细胞表面受体HLA-A的蛋白质和mRNA水平,验证了过表达hMEXB的水平会造成HLA-A的mRNA和蛋白质水平下降,同时突变GxxG和TR对会造成HLA-A的表达上调,从而解析hMEX3B调控HLA-A的分子机制。
该研究综合利用结构生物学,生物化学和细胞生物学的方法,系统深入地分析了hMEX3B蛋白质特异性识别底物HLA-A mRNA的分子机制。hMEX3B作为抗PD-1抗体治疗的负效应物,通过降解其mRNA来降低HLA-A的含量,从而增加肿瘤细胞的免疫逃逸(图2)。研究人员详细系统地研究了hMEX3B与其底物RNA相互作用的特点,特别是两个KH结构域自发协调工作的必要性。综上所述,此研究阐明了hMEX3B蛋白在肿瘤细胞免疫应答过程中如何在翻译抑制中发挥关键作用,这可能为靶向hMEX3B的潜在基因治疗提供了新的窗口,特别是对于PD-1抗体治疗失败的患者,并为研究其他MEX-3家族蛋白的分子机制和功能提供了思路和线索。
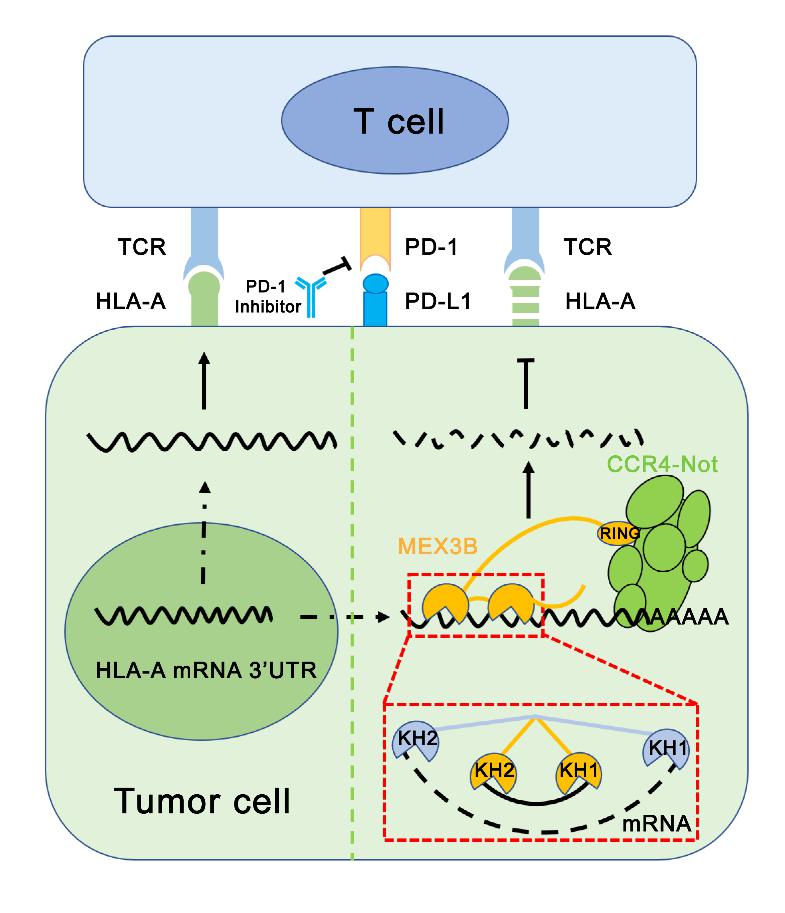
图2 hMEX3B在TCR免疫治疗过程中肿瘤逃逸中的功能模型
本工作于2024年2月8日以“Molecular mechanism of specific HLA-A mRNA recognition by the RNA-binding-protein hMEX3B to promote tumor immune escape”为题发表于《Communications Biology》。中国科学技术大学生医部博士研究生杨康龙为本文的第一作者。中国科学技术大学生医部特任副研究员张亮、施蕴渝教授和物理学院张志勇教授为本文的共同通讯作者。本研究得到细胞动力学教育部重点实验室、微尺度国家研究中心和合肥综合性国家科学中心大健康研究院的大力支持,以及中国科学院战略性先导计划、国家自然科学基金和中国科学技术大学青年创新基金等项目的资助,中科院生物物理所方显扬研究员和娄继忠研究员、中国科大姚雪彪教授、龚庆国教授、项晟祺教授和张家海教授为该工作的顺利开展提供了大力支持。
原文链接:https://doi.org/10.1038/s42003-024-05845-y
