人类脂肪酸氧化主要在线粒体和过氧化物酶体中进行,为细胞提供重要的能量物质,同时脂肪酸也参与许多重要的生理生化通路。超长链脂肪酸、支链脂肪酸、胆汁酸前体等脂肪酸由位于过氧化物酶体膜上的ABC转运蛋白 ABCD1、ABCD2和 ABCD3以酯酰辅酶 A 的形式跨膜转运进入过氧化物酶体。三者同为ABCD亚家族的转运蛋白,但具有各自的底物特异性:ABCD1主要转运饱和脂肪酸和单不饱和脂肪酸;ABCD2偏好多不饱和脂肪酸;而ABCD3转运长链脂肪酸、支链脂肪酸、胆酸盐前体、长链双羧酸等。它们的功能异常会导致严重人类疾病,例如ABCD1的突变会导致脂肪酸在过氧化物酶体内的代谢紊乱,引发 X 染色体伴性遗传的肾上腺脑白质营养不良症 (X-linked adrenoleukodystrophy,X-ALD) ;ABCD3 的突变则会导致胆汁酸前体在血液中积累,导致严重的肝脏损伤。前期中国科大陈宇星教授课题组对ABCD1 进行了结构和功能研究,阐释了其对超长直链脂肪酸的特异性识别和转运机制(Nat. Comm. 2022)。近期,该课题组继续解析了ABCD3的结构,该研究对阐明了其底物转运的分子机制,为深入理解脂肪酸代谢和过氧化物酶体缺陷病致病机制提供了理论基础。
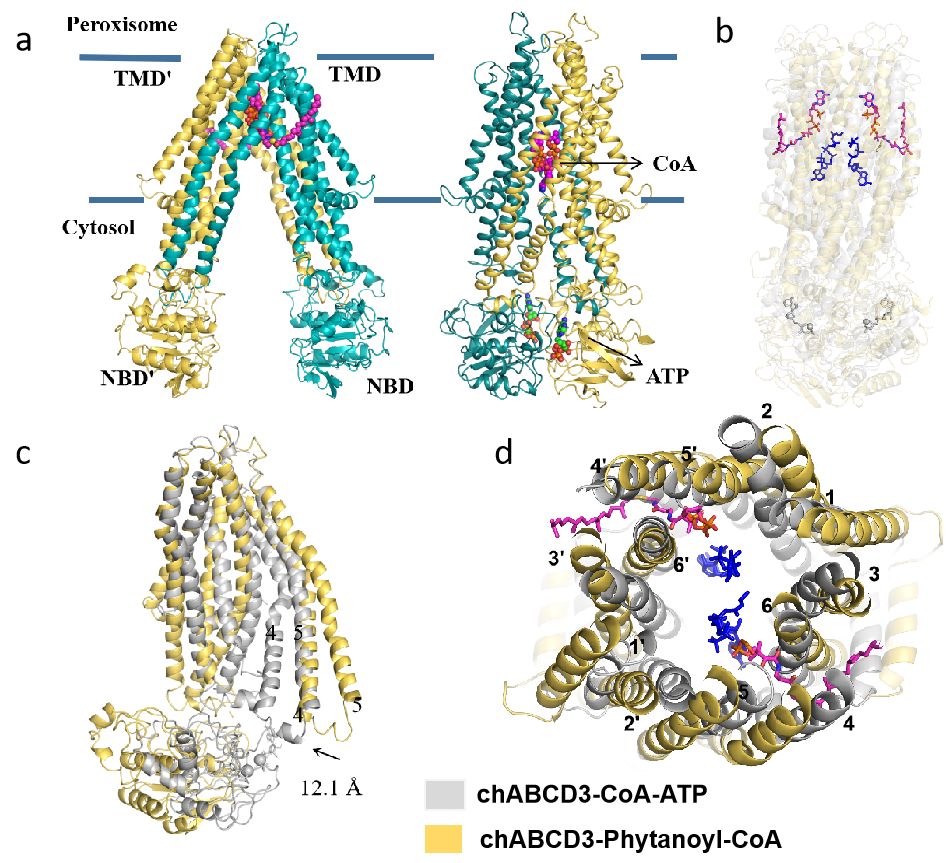
图1. ABCD3的三维结构
陈宇星教授课题组利用单颗粒冷冻电镜技术解析了人类脂肪酸转运蛋白ABCD3结合底物支链脂肪酸植烷酰辅酶A(phytanoyl-CoA)以及结合ATP/辅酶A的两种状态的三维结构,整体分辨率分别为2.9和3.2 Å(图1)。基于结构分析以及生化实验,研究人员提出了ABCD3识别和转运底物的分子机制,相关研究成果以“Structural insights into human ABCD3-mediated peroxisomal acyl-CoA translocation”为题的科学长文于2024年09月03日在《Cell Discovery》上在线发表。
在结合底物的复合物结构中,研究人员发现ABCD3呈现向细胞基质开放的构象,两个植烷酰辅酶A分子分别结合在同侧的一个跨膜结构域(TMD)上,其底物结合方式与前面报道的ABCD1结合脂酰辅酶A不同:ABCD1中每个底物底物分子都与在两个TMD紧密结合。当结合ATP时,ABCD3采取向过氧化物酶体开放的构象。在此结构中,两个辅酶A分子深嵌在转运通道中。通过结构分析和一系列生化功能实验,研究人员认为这两个构象分别是ABCD3在转运周期中的两种状态,并结合前期发表的ABCD1结构,提出了ABCD亚家族ABCD1-3的通用的转运循环机制模型(图2)。
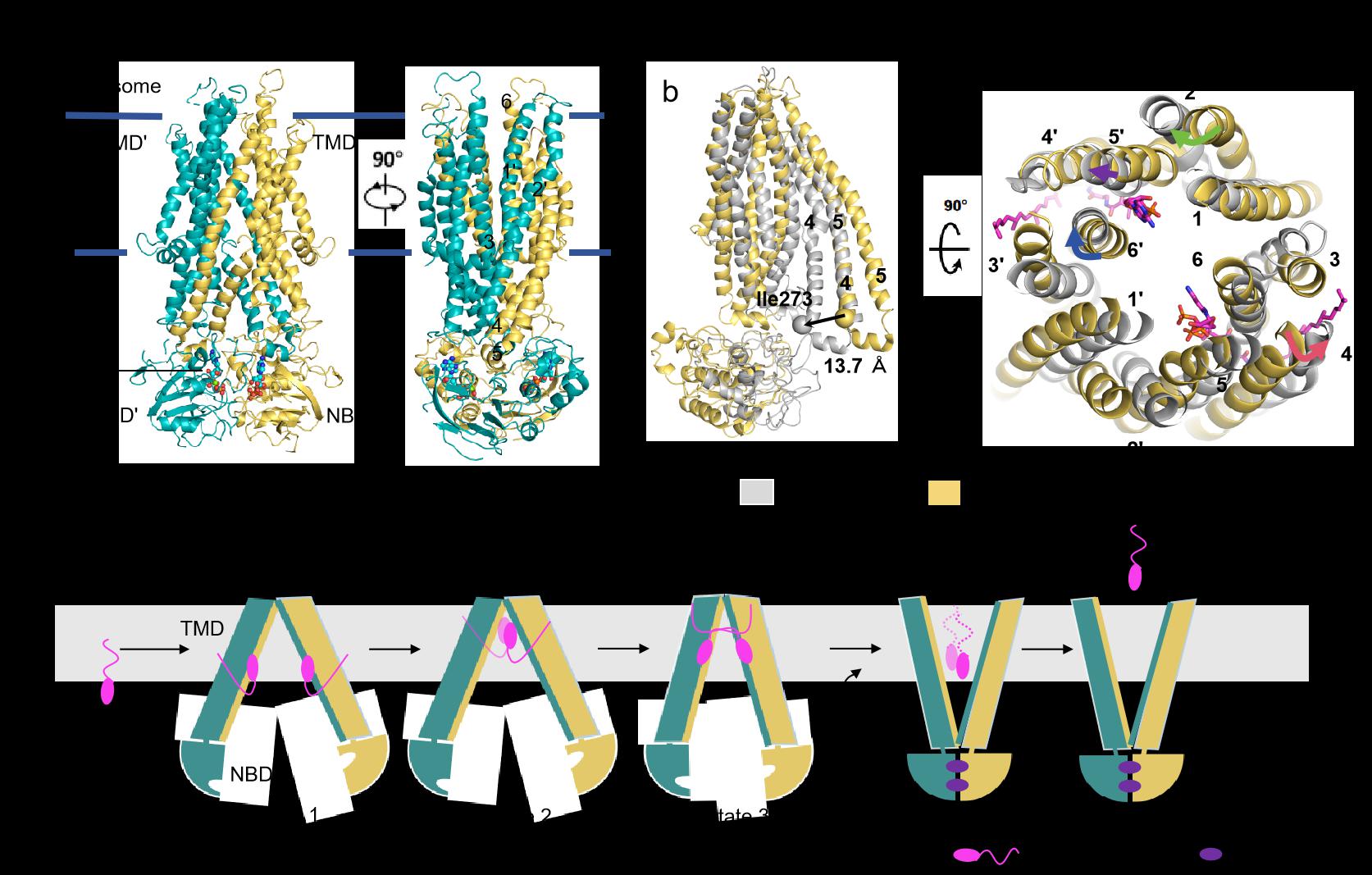
图2. ABCD3转运植烷酰辅酶A(phytanoyl-CoA)的机制模型
中国科学技术大学侯文韬副教授和陈宇星教授为该论文的共同通讯作者,博士生李阳和博士后陈志鹏为该论文的第一作者。冷冻电镜数据收集工作在中国科学技术大学集成影像中心完成。该研究得到了科技部、国家自然科学基金委和中国科学院的资助。
