近年来,为了突破现有药物研发技术的诸多瓶颈,靶向蛋白降解(Targeted Protein Degradation, TPD)技术应运而生。这一技术为药物开发开辟了新的路径,其核心原理在于利用细胞自身的蛋白质降解机制(例如蛋白酶体途径、溶酶体途径等)来实现靶蛋白的降解。其中,溶酶体靶向嵌合体(lysosome-targeting chimeras, LYTACs)技术,由2022年诺贝尔化学奖得主Carolyn Bertozzi首次提出,作为一种新型的TPD策略,显著拓展了TPD的应用范围,不仅限于胞内蛋白,还包括胞外蛋白和膜蛋白。目前,LYTAC技术已在肿瘤治疗、慢性眼病以及神经退行性疾病等多个领域展现出应用潜力。LYTAC技术依赖于溶酶体受体来实现靶蛋白的降解,其中,ASGPR(Asialoglycoprotein Receptor)是一种特异性表达于肝细胞的溶酶体靶向受体,其主要生理功能是帮助肝细胞清除循环系统中缺乏N端寡糖链的老化蛋白质。因此,通过设计ASGPR配体构建的LYTAC化合物,能够高效地通过肝细胞溶酶体途径降解分泌至胞外及膜上的靶蛋白,表现出高安全性和低毒副作用,巧妙地利用了机体清除老化蛋白的自然机制来降解与疾病相关的靶蛋白,具有重要的临床转化价值。

2024年12月11日,中国科学技术大学生命科学与医学部、免疫应答与免疫治疗重点实验室王毅课题组在Cell Reports Physical Science在线发表了一篇题为“A heparanase-specific LYTAC degrader reinforces natural killer cell cytotoxicity within tumor microenvironment”的研究文章。本研究采用LYTAC技术设计合成了一种针对肝癌微环境中肝素酶(heparanase, HPA1)的靶向降解化合物JW-9。该化合物通过增加肿瘤细胞表面硫酸乙酰肝素蛋白聚糖(HSPGs)的丰度,激活自然杀伤(NK)细胞表面的自然细胞毒性受体(NCRs),从而显著增强了NK细胞对肝癌的识别与杀伤能力。此外,该LYTC化合物JW-9巧妙利用机体清除老化蛋白的ASGPR系统来降解肝瘤靶蛋白HPA1,因地制宜地借助肝癌细胞自身溶酶体系统降解肝癌免疫抑制性分子,从而增强NK细胞的抗肝癌效应。
在本研究课题中,设计了一种名为JW-9的LYTAC双功能化合物,该化合物包含两个不同的结合区域,这两个区域通过一个化学连接子(linker)连接。其中一个结合区域能够与肝细胞表面的特异性跨膜受体ASGPR相结合,此受体负责将携带N-乙酰半乳糖胺(N-acetylgalactosamine, GalNAc)标记的蛋白质转运至溶酶体进行降解。另一个结合区域则与目标蛋白(protein of interest, POI)结合,用于识别特定的胞外蛋白,即JW-9的目标蛋白HPA1。当JW-9分子的两个结合区域同时与其各自的配体结合时,会形成一个三元复合物(ASGPR-LYTAC-HPA1)。随后,该复合物会被细胞膜内吞,形成运输囊泡,将复合物运送至溶酶体进行降解,而ASGPR受体则被回收利用,重新回到细胞膜上准备下一次的降解过程。随着HPA1的降解,肝瘤细胞表面的HSPGs丰度增加,从而促进NK细胞对肝癌的识别与杀伤能力,使得NK细胞突破肿瘤微环境的抑制性屏障(见图1)。
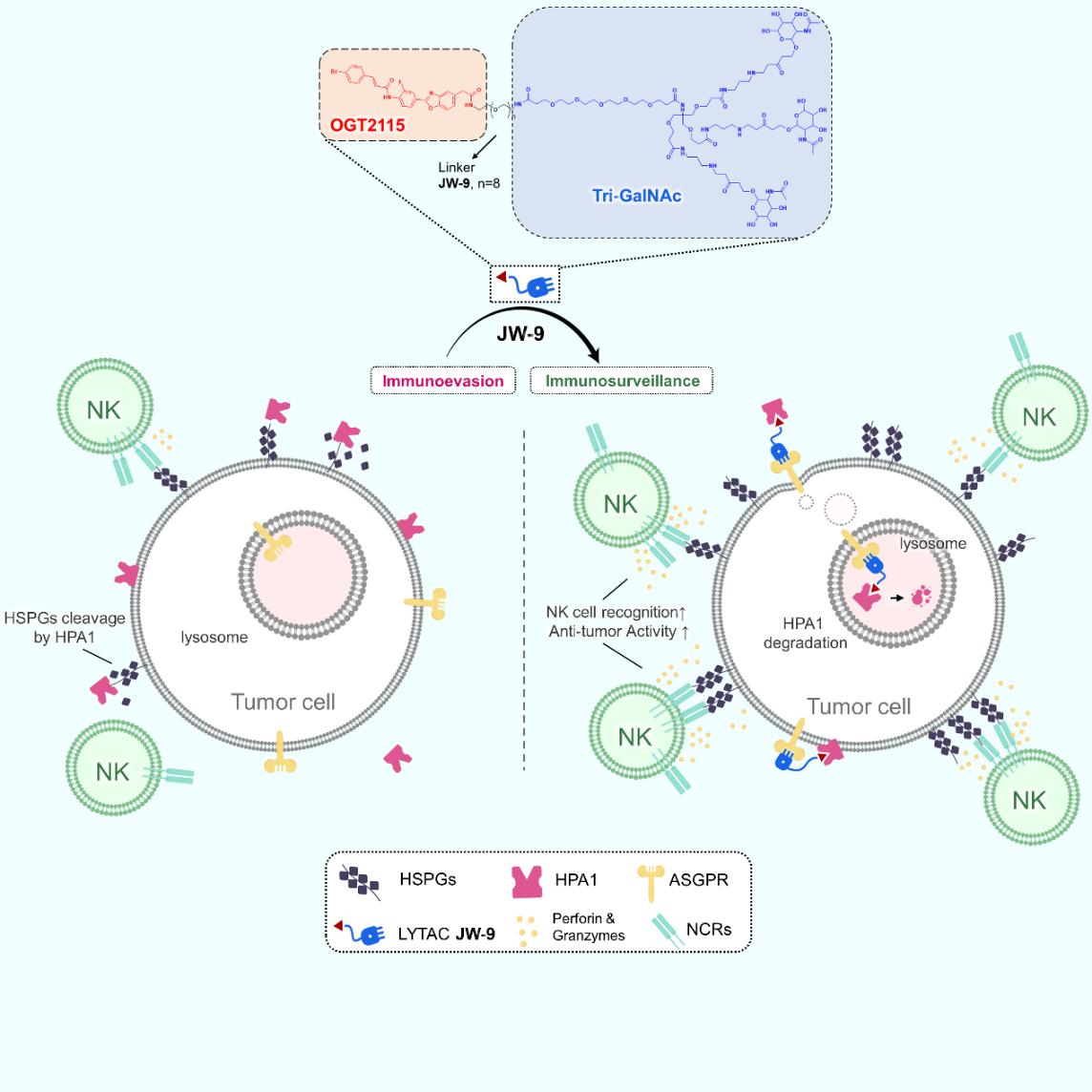
图1 LYTAC化合物JW-9增强 NK 细胞的抗肝癌效应
综上所述,JW-9借助ASGPR-GalNac系统靶向降解肝癌中介导免疫抑制的靶蛋白HPA1,该体系安全可靠且毒副作用低,不但克服了传统靶向药 “仅占位
降解”的难题,而且通过肿瘤免疫学与化学生物学的交叉融合,为肝癌免疫治疗提供了安全有效的新思路,为后续深入探究靶向降解蛋白技术在肿瘤中的应用提供了新线索。
中国科学技术大学生命科学与医学部博士生李昀佳、博士后沈亦青、附属第一医院陈浩副主任医师为该论文的第一作者。中国科学技术大学基础医学院、免疫应答与免疫治疗重点实验室王毅研究员和金晶副研究员为该论文的通讯作者。该研究工作获得了中国科学技术大学生命科学与医学部魏海明教授、薛林教授,附属第一医院黄玫副研究员等合作团队的大力支持,以及中国科学院战略性先导科技专项、国家自然科学基金、安徽省自然科学基金、合肥综合性国家科学中心大健康研究院全球遴选项目-创新药物等项目资助。
文章链接:https://www.cell.com/cell-reports-physical-science/fulltext/S2666-3864(24)00653-2
