泛素-蛋白酶体系统(UPS)可通过降解关键线粒体蛋白参与线粒体质量控制。在之前的研究中,许超团队、张凯铭团队与以色列Itay Koren团队合作揭示了CRL2FEM1B E3泛素连接酶复合物的组装、激活与底物识别机制(Nat Chem Biol, 2021; Nat Commun, 2024)。近期研究表明,CRL2FEM1B E3介导FNIP1蛋白质的泛素化降解影响成肌细胞的分化。作为CRL2 E3复合物中负责底物识别的亚基,FEM1B还参与调控线粒体蛋白的输入过程。然而在FEM1B敲除细胞中,线粒体形态缺陷无法完全归结于FNIP1的过量累积,这暗示了线粒体中还存在受CRL2FEM1B E3调控的未知底物。此外,FEM1B缺少线粒体定位信号,CRL2FEM1B复合物在线粒体的定位机制也未被揭示。
2025年4月22日,中国科学技术大学许超团队与以色列巴伊兰大学Itay Koren团队再度合作,在《Nature Chemical Biology》杂志发表论文,揭示出CRL2FEM1B E3定位于线粒体的机制,并阐明了CRL2FEM1B通过调控线粒体蛋白PLD6稳态影响线粒体动力学的机理。
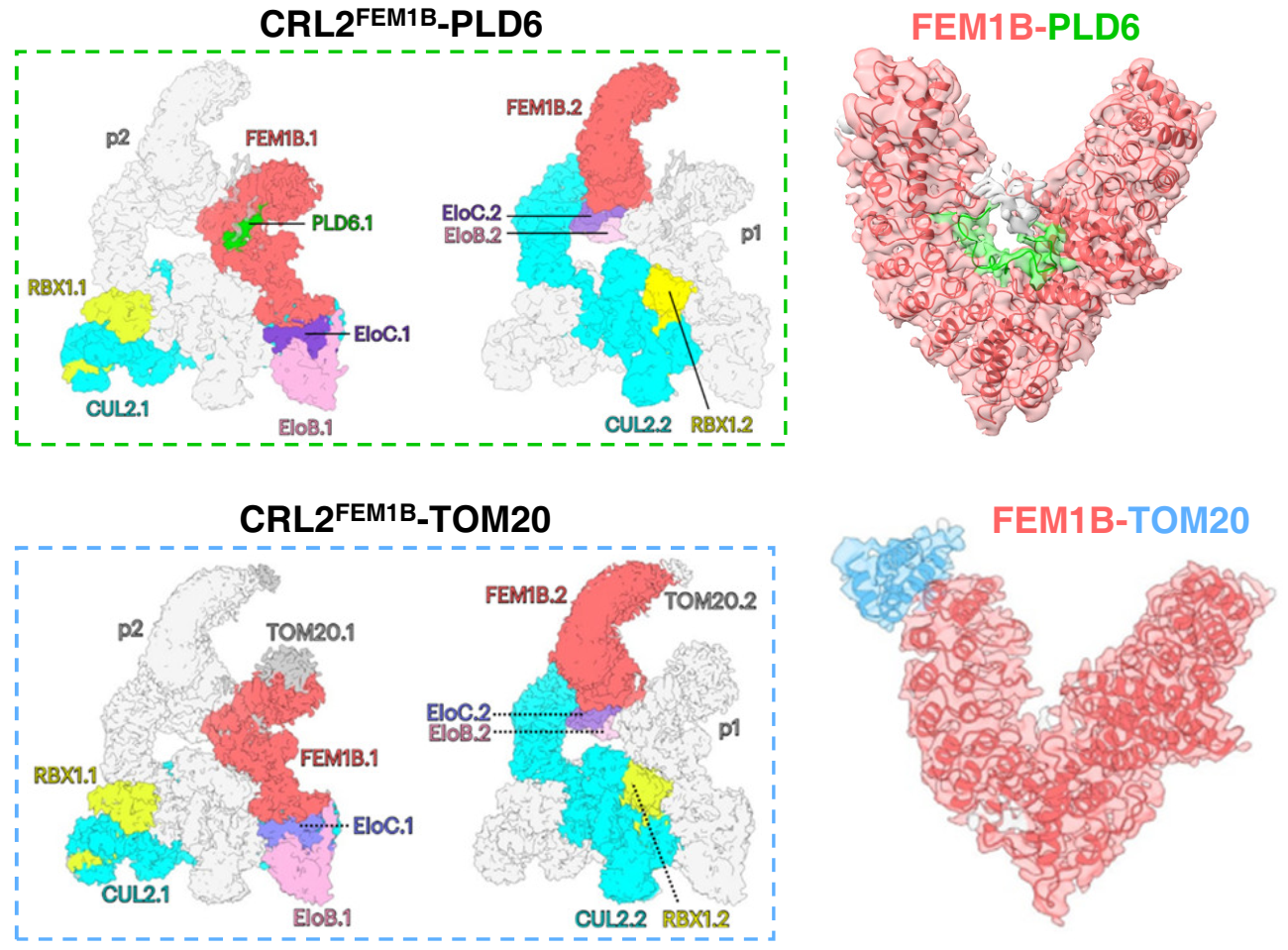
研究人员首先通过蛋白质组学定量分析鉴定出若干受CRL2FEM1B E3调控的底物,其中包括线粒体脂酶PLD6。该磷脂酶通过水解心磷脂生成磷脂酸(PA)促进线粒体融合。研究人员利用生物化学方法验证FEM1B直接结合PLD6,并通过冷冻电镜解析了CRL2FEM1B E3与PLD6的复合物结构。结构分析表明,CRL2FEM1B复合物表现为非对称二聚体结构。进一步对FEM1B-PLD6相互作用界面进行分析发现,PLD6缺乏FEM1B底物所具有的C-degron特征,但其羧基端序列以相似的模式与FEM1B的底物结合口袋相互作用(图1A-C)。FEM1B的敲除导致线粒体的核周聚集,同时敲除PLD6可恢复线粒体的正常形态,表明CRL2FEM1B通过介导PLD6的泛素化降解防止线粒体过度融合。此外,研究人员通过细胞生物学与生物化学实验发现FEM1B与TOM20共定位于线粒体外膜,且两者之间存在直接的相互作用。利用冷冻电镜解析CRL2FEM1B与TOM20的复合物结构后发现,TOM20与FEM1B的氨基端ankyrin结构域相互作用,远离底物PLD6结合位点。在敲除FEM1B的细胞中引入TOM20结合突变体FEM1B 5E后,发现该突变体无法定位于线粒体外膜,导致线粒体中的PLD6无法被有效降解,从而引发线粒体过度融合。与之相对比的是,5E突变体虽然无法定位于线粒体,其仍然可以调控细胞质中的底物降解,表明FEM1B的线粒体定位与其调控细胞质中蛋白质降解的功能相互独立。
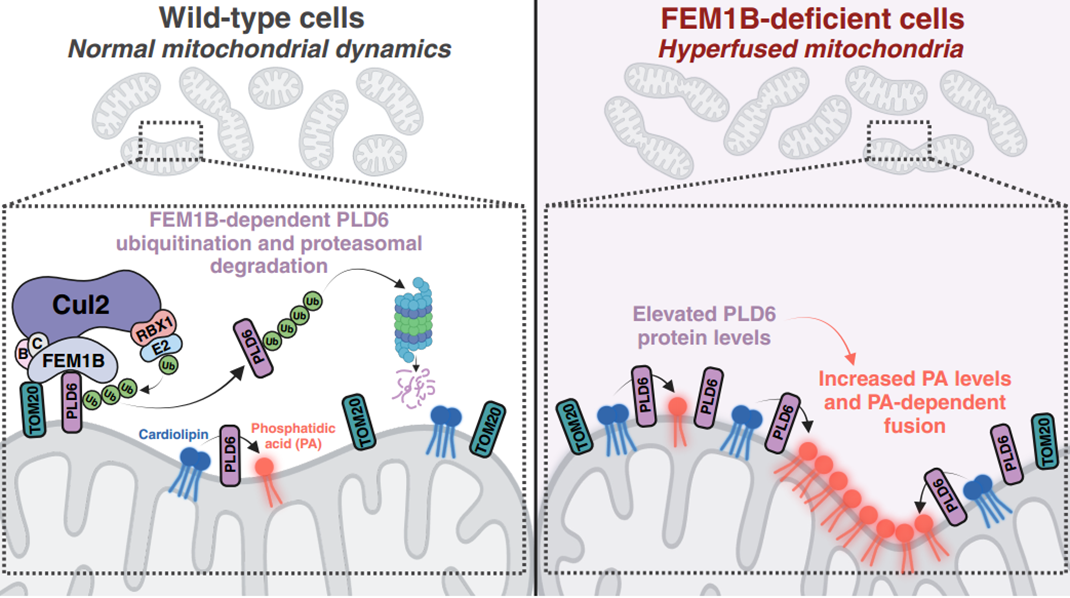
研究人员基于以上研究建立了CRL2FEM1B泛素连接酶被TOM20招募至线粒体外膜后,介导脂酶PLD6泛素化降解调控线粒体动力学的模型。该模型不仅为深入理解UPS通路在线粒体质量控制中的作用机制提供了结构基础,还为未来靶向FEM1B开发靶向降解线粒体蛋白质的化学工具提供了靶标。
许超教授与Itay Koren教授为该论文的共同通讯作者,Itay Koren教授课题组的Anat Raiff与许超教授课题组的博士生赵是栋为该论文的共同第一作者。中国科学技术大学冷冻电镜中心高永翔博士为冷冻电镜数据收集提供了支持和帮助。研究受到国家自然科学基金、科技部重大研究计划、合肥大健康研究院培育基金等项目的资助,并得到细胞动力学教育部重点实验室、合肥微尺度物质科学国家研究中心的大力支持。
原文链接:https://www.nature.com/articles/s41589-025-01894-4
