近日,中国科学技术大学王雪娟团队合作,在国际权威期刊《Science Bulletin》上在线发表题为Molecular architecture and inhibition mechanism of human ATR-ATRIP的研究论文。该研究解析了人源ATR-ATRIP激酶复合体结合临床候选抑制剂VE-822和RP-3500复合物的三维结构,整体分辨率达3 Å,系统揭示了小分子抑制剂的结合机制及其特异性来源,为抗肿瘤ATR抑制剂的理性设计提供了坚实的结构基础。
ATR激酶是DNA损伤应答与复制压力应答过程中的顶端激酶,ATR响应多种DNA损伤的活化机制是基因组稳定领域的核心生物学问题。ATR由2644个氨基酸组成,其N端2205个氨基酸构成高度动态的α- 螺线管。ATR与含791个氨基酸的伴侣蛋白ATRIP结合,形成两个ATR-ATRIP异源二聚体的同源二聚体以发挥功能。目前,仅有1个4.7埃分辨率的人源ATR-ATRIP结构被解析,且其ATRIP的化学计量比尚不明确(Cell Research, 2018),这些都极大限制了对ATR活性调控机制的深入认识。
复制应激是基因组不稳定性的主要原因,也是癌细胞的一个关键脆弱点。这种脆弱性可以通过靶向抑制ATR激酶进行精准治疗。抑制ATR启动的DNA损伤反应会将DNA片段释放到细胞质中,引发先天免疫反应。目前,有十几种ATR小分子抑制剂正处于临床评估阶段,它们被用作单药疗法或与化疗、免疫检查点抑制剂联合使用,旨在利用肿瘤细胞特有的高复制应激,克服治疗耐药性并增强抗肿瘤免疫效果。然而,至今尚未解析出ATR与任何一种抑制剂,甚至ATP类似物的复合物结构,这在很大程度上限制了ATR抑制剂的药理学优化进程。
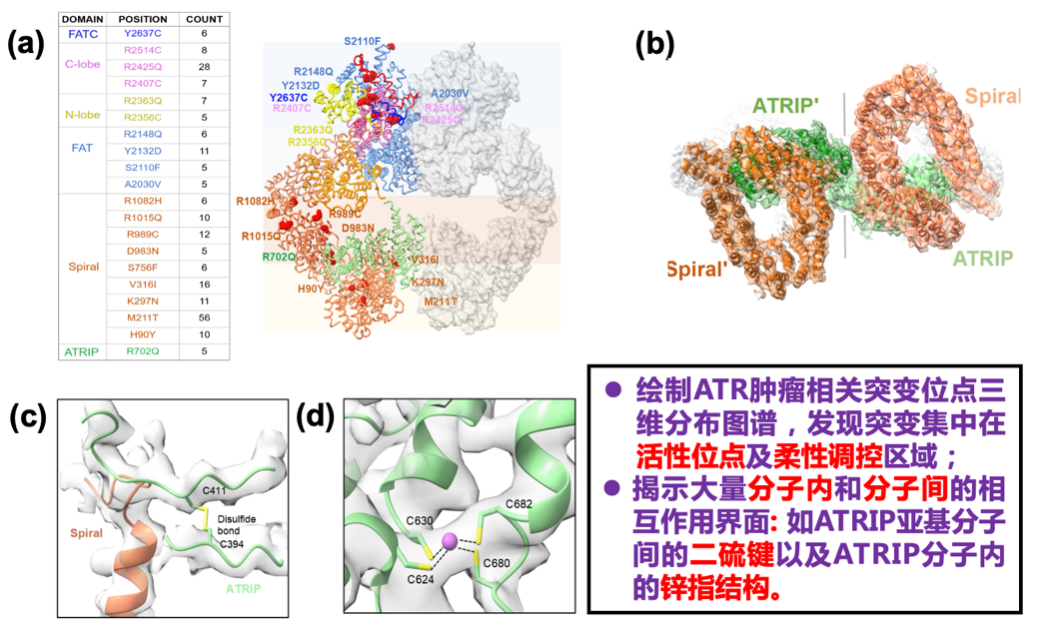
本研究通过BacMam系统在哺乳动物细胞中高效表达ATR-ATRIP复合体,结合氧化石墨烯膜辅助冷冻电镜技术,成功获得了ATR-ATRIP结合多种小分子抑制剂或ATP类似物的复合物结构,分辨率最高达2.75 Å,首次成功构建了完整人源 ATR-ATRIP 复合体的原子模型,这一成果纠正了以往基于序列和低分辨率冷冻电镜三维重构所构建的ATRIP全长及ATR N端1200个氨基酸结构模型的诸多错误。高分辨率结构也清晰揭示了ATR-ATRIP复合物内部大量分子内和分子间的相互作用界面,例如ATRIP亚基分子间的二硫键以及ATRIP分子内的锌指结构。此外,将ATR 肿瘤相关突变位点绘制成三维分布图谱后,发现这些突变主要集中在活性位点及柔性调控区域,进一步有力验证了结构功能关联的重要性。
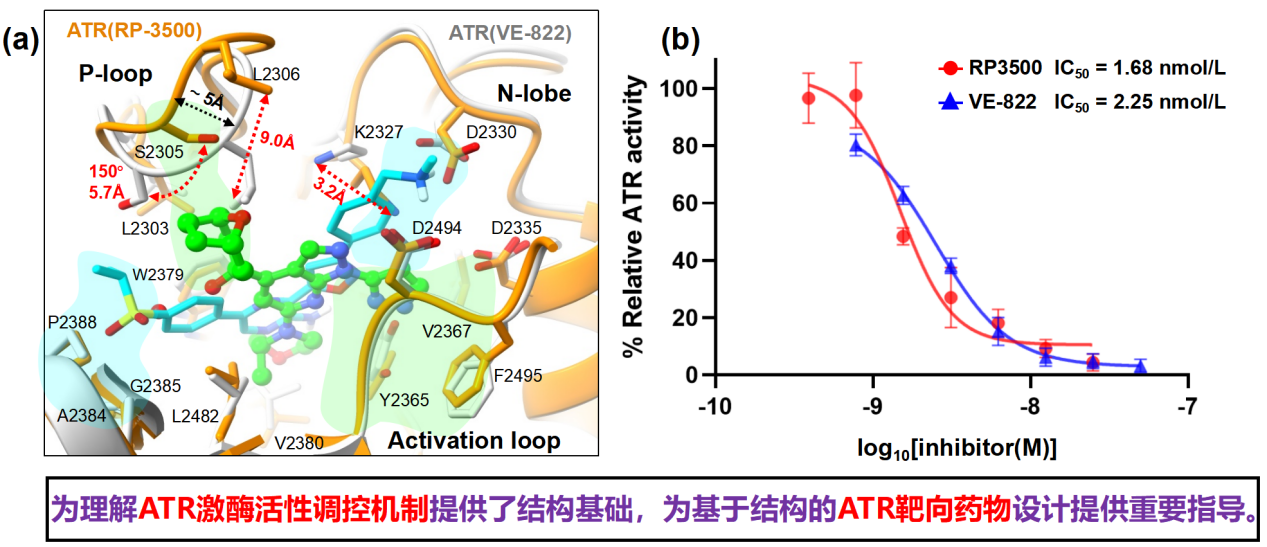
通过比较分析,我们深入阐释了两种最广泛临床实验的 ATR 抑制剂的作用模式及其选择性的结构基础。结构揭示出VE-822和RP-3500展现出不同的结合方式,引发了ATR活性位点发生了不同的构象变化。令人意外的是,一个ATR-ATRIP复合物可结合四个VE-822分子,其中两个位于ATR的活性位点,另外两个则位于 ATR-ATR二聚体界面。与此同时,RP-3500的结合和选择性依赖于两个结合水分子的存在,形成了独特的氢键识别模式。研究指出,VE-822和RP-3500结合ATR活性中心的特异性可能分别通过改善二体界面的非特异性结合或取代结合水分子而进一步增强。本研究不仅为理解 ATR 的调控机制提供了结构基础,而且为后续开发高效、高选择性的靶向ATR的小分子抗肿瘤抑制剂提供了坚实的结构基础。
本研究由中国科学技术大学王雪娟教授和蔡刚教授课题组联合完成,2024级博士研究生王光显为论文第一作者。研究工作获得国家自然科学基金、中国科学院战略性先导科技专项、合肥大健康研究院等项目支持,并感谢中国科大冷冻电镜平台高永翔、唐培萍老师在数据采集方面提供的重要技术支持。
DOI: 10.1016/j.scib.2025.05.009
文章链接:https://www.sciencedirect.com/science/article/abs/pii/S209592732500489X
