急性髓系白血病(AML)治疗后的高复发率,一直是临床面临的严峻挑战,其根源在于传统化疗和靶向治疗难以彻底根除作为“癌种”的白血病干细胞(LSCs)。以往研究大多聚焦于从分子、遗传、代谢等多角度探索LSCs的特性,而对其物理力学特性及其在耐药与免疫逃逸中的作用知之甚少。
2025年12月1日,中国科学技术大学生命科学与医学部、免疫应答与免疫治疗全国重点实验室倪芳教授与中国科学技术大学工程科学学院近代力学系姜洪源教授团队合作在《Nature Communications》在线发表题为“Targeting leukemic stem cell biomechanics suppresses stemness and enhances NK cell mediated immunotherapy”的研究论文。该研究系统揭示了AML中LSCs独特的物理力学特性,并创新性地提出通过调控其力学性质来增强免疫治疗效果的联合治疗新策略,为克服AML耐药与复发难题提供了全新视角和潜在途径。
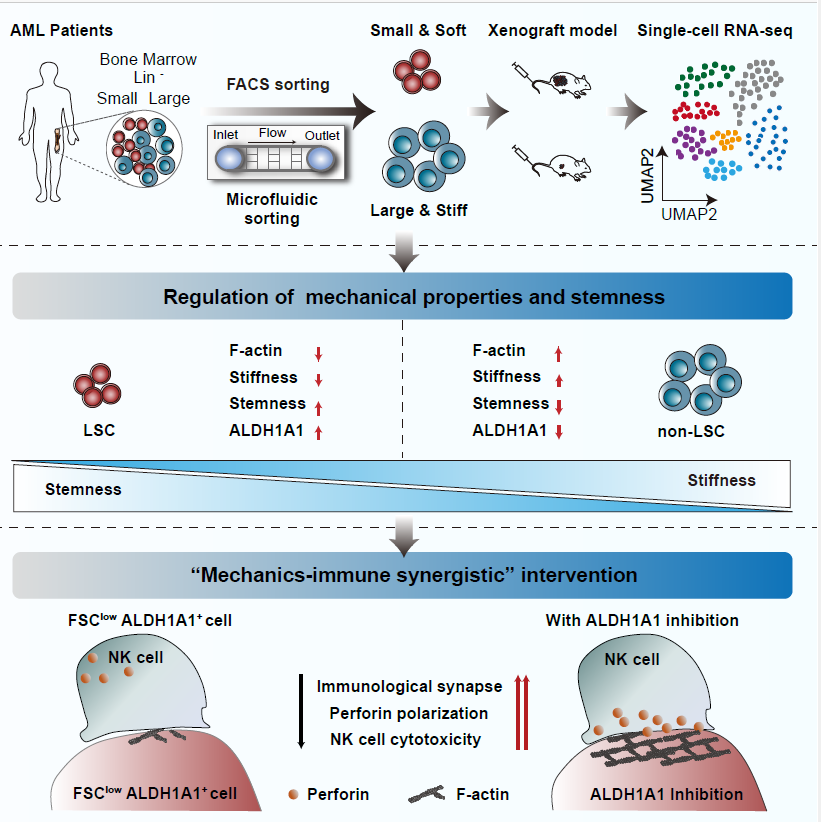
本研究独辟蹊径,从细胞力学生物学角度切入,发现那些具有最强干性、致病能力和耐药性的LSCs,普遍具有“小而软”的物理特征。团队利用自主研发的微流控芯片技术,成功实现了基于力学性质的“小而软”白血病的高纯度、无标记分选,为精准捕获LSCs提供了创新工具。随后,通过单细胞测序技术,团队在AML患者样本中精准鉴定出一个富含LSCs的关键亚群:FSClow ALDH1A1+细胞。这一亚群不仅干性特征显著,其细胞骨架蛋白F-actin的水平也更低,细胞皮层更软。深入研究揭示,ALDH1A1不仅是该亚群的标志物,更是一个调控细胞力学属性的关键开关。当使用ALDH1A1抑制剂或基因手段抑制ALDH1A1后,LSCs内的F-actin发生聚合,细胞随之“变硬”。这一力学性质的改变,直接导致LSCs自我更新和致白血病能力下降,对化疗药物更敏感。
更为重要的是,研究发现了力学调控与免疫治疗之间的增效桥梁。LSCs的“柔软”状态可能帮助其逃避免疫监视。当ALDH1A1被抑制、细胞“变硬”后,它们与自然杀伤(NK)细胞之间的免疫突触形成更为牢固,NK细胞杀伤颗粒的极化与释放效率大幅提升,从而像“撕破防御铠甲”一样,极大增强了NK细胞对LSCs的清除能力。在AML患者来源的异种移植模型中,联合使用ALDH1A1抑制剂与NK细胞输注,展现了远优于单一疗法的协同抗白血病效果,且该策略对正常的造血干细胞未显示明显毒性,安全性良好。
该研究率先将LSCs的生物力学特性、分子标志物功能与免疫治疗应答有机联结,突破了以往主要关注生化信号的传统研究范式,开创了“力学-免疫”协同治疗白血病的新领域。它不仅为AML的精准干预提供了新的生物物理靶点,其核心原理也为其他干细胞驱动型肿瘤的治疗策略研发带来了重要启示。
中国科学技术大学博士后朱明明、博士后杨皓翔、博士生邱凯龙为本文的共同第一作者,中国科学技术大学生命科学与医学部、免疫应答与免疫治疗重点实验室倪芳教授为最后通讯作者,中国科学技术大学近代力学系姜洪源教授为本文的共同通讯作者。该研究还得到中国科学技术大学附属第一医院血液科朱小玉主任、郑昌成主任、安徽医科大学第一附属医院血液科刘沁华主任的大力支持,该研究得到了国家自然科学基金、中国科学院先导专项、科大新医学等项目资助。
