北京时间2026年1月22日18时,中国科学技术大学张凯课题组与科罗拉多州立大学Steven Markus课题组在《自然—化学生物学》(Nature Chemical Biology)发表合作研究成果,揭示了一种调控胞质动力蛋白-1(cytoplasmic dynein-1,简称dynein)活化的“核苷酸密码(nucleotide code)”,并发现了此前未被报道的关键中间态。

Dynein是一种沿微管运输多种细胞物质的重要分子马达,参与组织形态发生、有丝分裂等关键细胞过程。为了确保其在正确的时空环境中被激活,dynein的活性受到严格调控。其中,自抑制构象(因形似希腊字母Φ而被称为Phi构象)是其调控的关键中间态。光滑脑回(lissencephaly)相关蛋白Lis1被认为是解除dynein自抑制的重要激活因子。尽管已有大量细胞学、生化及结构研究表明Lis1可“打开”dynein的自抑制或稳定其开放(open)构象,但Lis1在全长dynein背景下发挥作用的精确分子机制仍不明确。
其中的一个主要挑战在于:Lis1与dynein之间存在多种结合模式,这为机制研究带来了长期困扰。此前针对dynein马达结构域截短体的研究表明,Lis1既可以通过单个WD40结构域与马达结构域结合,也可以通过两个WD40结构域同时结合一个马达结构域。由于dynein马达含有多个AAA+结构域(各自处于不同的核苷酸状态),此前研究已观察到Lis1结合模式受这些核苷酸状态的影响。然而,Lis1结合模式如何被不同核苷酸状态调控,以及不同结合模式如何影响全长dynein的构象,一直缺乏系统的理解。
受到“微管密码(tubulin code)”与“组蛋白密码(histone code)”概念的启发,团队提出dynein可能同样存在“核苷酸密码”——即其多个AAA+模块的核苷酸状态组合共同决定Lis1的结合方式与dynein的构象状态。为了验证该假说,研究团队以出芽酵母dynein为模型,通过在马达结构域(截短体)中特定AAA+模块引入影响核苷酸结合或水解的突变,利用质量光度法定量分析Lis1–dynein的结合特性。结果显示,AAA1、AAA3和AAA4模块协同调控Lis1的亲和力,而不同的核苷酸状态决定Lis1结合的化学计量比,从而解释了以往文献中部分相互矛盾的结果。尤其值得注意的是,当AAA3处于apo(未结合核苷酸)状态时,一个Lis1二聚体可通过其两个WD40结构域“桥接”两个马达结构域。这一现象在全长dynein中同样得到验证,即一个Lis1二聚体可同时结合一个全长dynein分子的两个马达结构域。负染电镜分析进一步表明,这种“桥接”对应的dynein处于一种“开放”构象,极有可能代表其活化过程中的关键中间态(图1)。
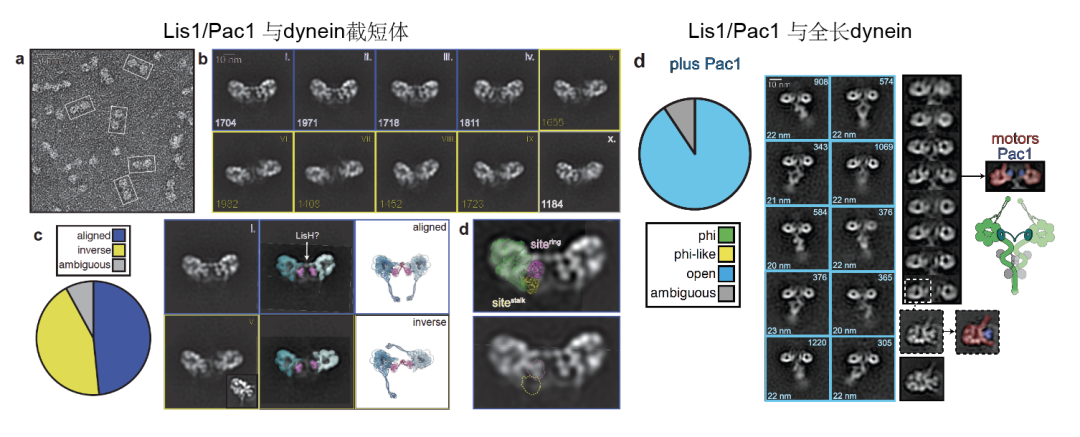
图1: 一个Lis1二聚体通过其两个WD40结构域同时桥接Dynein的两个马达结构域
为了阐明这种桥接作用的结构基础,研究团队利用单颗粒冷冻电镜(cryo-EM)解析了全长Dynein–Lis1复合物的结构。结果显示,每个dynein马达结构域与Lis1的一个WD40结构域相互作用,这与负染结果一致,且Lis1结合与AAA3的apo状态密切相关。高分辨率结构分析进一步揭示,dynein的杠杆臂结构域(linker)与Lis1 WD40表面之间存在一种此前未被发现、甚至曾被认为不存在的新型接触界面。研究者推测,该linker–Lis1相互作用可稳定AAA3的apo状态,从而决定Lis1结合的化学计量比并调节dynein自抑制的解除。基于结构的界面突变实验,以及配合的生化与细胞功能验证,进一步支持了这一模型(图2)。
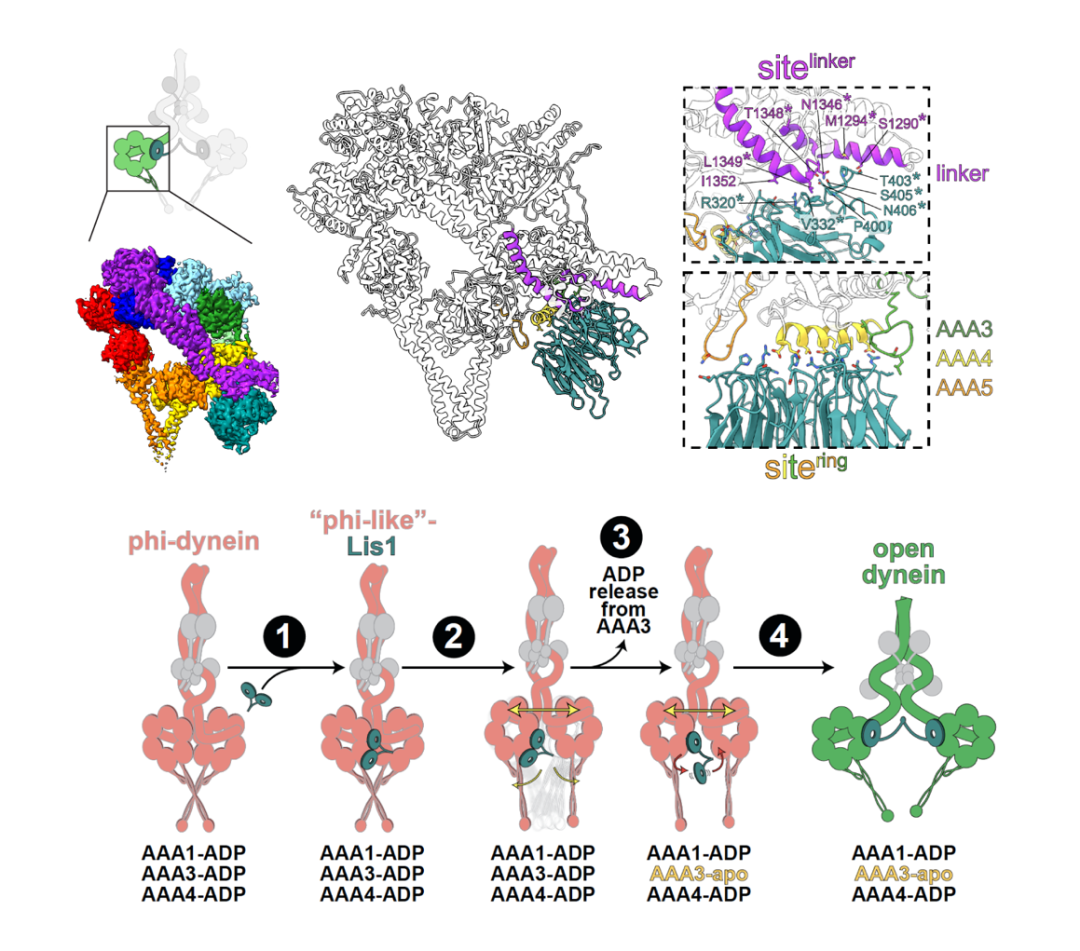
图2: Lis1与Dynein马达结构域的结合及活化模型
该研究的共同第一作者包括科罗拉多州立大学Markus课题组的Indigo C. Geohring与Bharat R. Iyer博士,以及张凯课题组的柴鹏鑫博士(现为哈佛大学博士后)。该研究获得NIH资助及耶鲁电镜中心支持。
值得一提的是,张凯课题组近期与Yildiz团队在人源dynein研究中发现了一种特殊的过渡态复合物PhiL-Lis1,并系统证明该复合物在Lis1/Nde1介导的dynein激活机制中起到关键作用。这一发现与本项研究结果在不同维度充分互补,进一步丰富了对dynein活化机制的理解。
相关论文信息:
https://doi.org/10.1038/s41589-025-02096-8
