制作合适的基因编辑细胞模型或转基因动物模型在基础研究领域(如生殖生物学、细胞生物学、肿瘤生物学等)或临床转化研究领域(如细胞替代治疗、精准基因治疗等)是不可或缺的手段和技术方法。目前CRISPR-Cas9及其拓展工具(碱基编辑器、先导编辑器等)已实现小片段DNA的高效精确删除、替换与插入,但千碱基级大片段DNA敲入效率低、精准性差的问题,长期制约着基础研究与转化应用的发展。大片段基因敲入在构建长片段基因敲入细胞和模式动物模型、制备治疗用途的CAR-T细胞以及赋予细胞特殊生物性状(如植物抗病抗逆性)等方面具有不可替代的价值,因此开发新型高效精准的大片段基因敲入工具,成为该领域的重要研究方向。
2025年12月10日,中国科学技术大学鲍坚强课题组、程临钊课题组,联合南京医科大学王成坤课题组以及山东大学刘洪彬课题组、张友明课题组在Nature Communications杂志发表了题为“Efficient high-precision transgene knock-in by Recombinases (Redα/β)-enhanced DNA integration-CRISPR-Cas9 (RED-CRISPR)”的研究论文,报道了一种基于Redα/β重组酶增强的高效精准大片段基因敲入RED-CRISPR系统,为解决上述瓶颈提供了创新方案。原文链接:https://doi.org/10.1038/s41467-025-67239-w
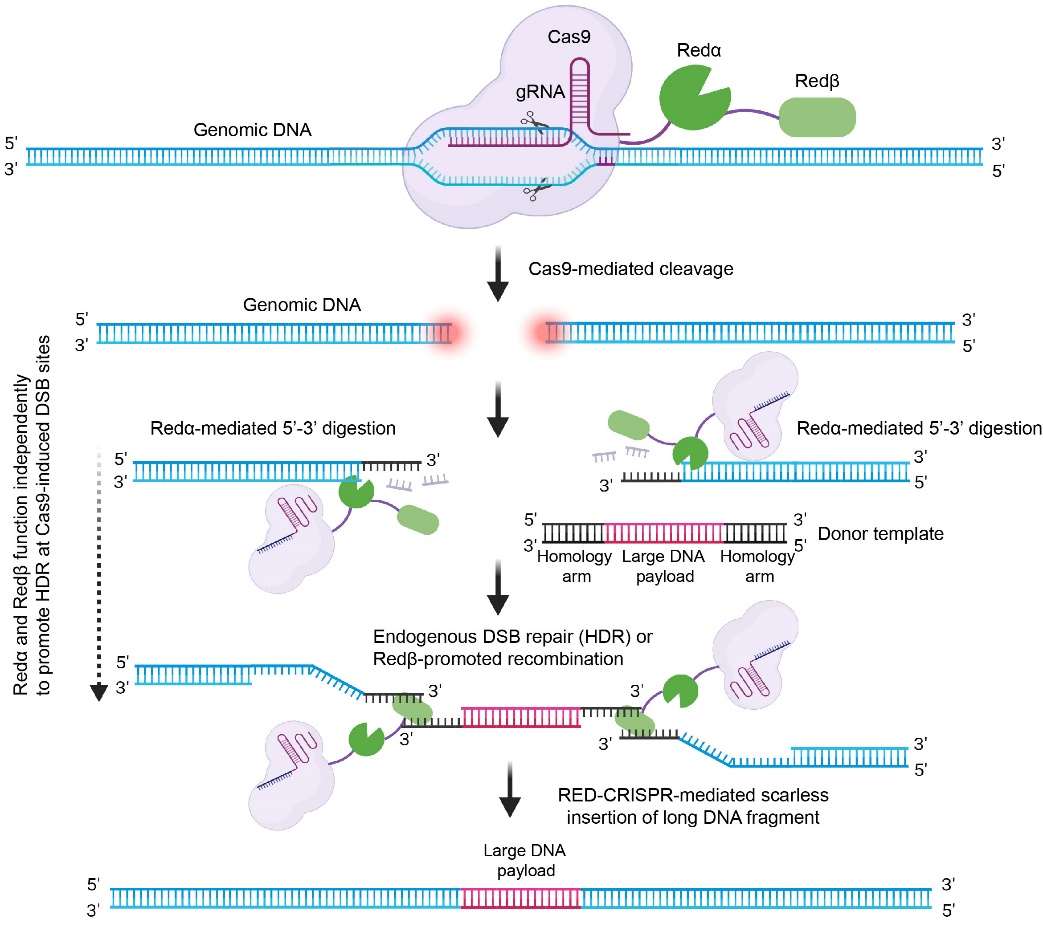
Redα/β系统是λ噬菌体中进化的一种高效同源重组(HR)系统,该系统由Redα和Redβ两种重组酶构成。其中,Redα是一种外切酶,负责沿5’到3’方向消化DNA双链断裂(DSB)末端形成3’单链悬垂结构;Redβ是一种单链DNA退火蛋白(SSAP),通过链退火或链交换促进重组过程的完成。
RED-CRISPR系统的设计与优化:作者分别设计了Cas9-Redα、Cas9-Redβ、Cas9-Redα-Redβ、Redα-Cas9-Redβ融合蛋白以及各类“游离型”Redα + Redβ与Cas9共表达。在进行蛋白间linker与核定位信号(NLS)等原件优化后,于哺乳动物细胞系中进行长片段DNA(>1 kb)敲入测试。实验结果显示:Cas9-Redα-Redβ融合蛋白效率最高(相对于Cas9提升2-5倍),因此将Cas9-Redα-Redβ命名为RED-CRISPR系统。进一步联用RED-CRISPR + 小分子HDR增强剂 + CTS同源修复模板,可在细胞系中实现>40%的千碱基级DNA敲入效率。
RED-CRISPR系统的表征与安全性评估:
(1)作者通过NGS测序检测不同时间段的NHEJ(非同源末端连接修复)与HDR(同源定向修复)事件比例发现,RED-CRISPR通过抑制NHEJ的发生从而提高HDR效率;
(2)与单独Cas9相比,RED-CRISPR具有更高的精确性和多等位基因编辑能力,且未造成额外的细胞毒性;
(3)与已报道的基因敲入优化策略相比,RED-CRISPR的效率与之相当或高于这些方法,并且RED-CRISPR能够与这些方法完好兼容,协同提升敲入效率。
(4)基因组范围脱靶编辑事件分析(GUIDE-seq)与染色质易位事件分析(PEM-seq)结果显示,RED-CRISPR系统编辑时脱靶编辑事件和染色质易位事件显著降低,表明RED-CRISPR具有更高的安全性,有潜在的临床应用价值。
RED-CRISPR系统的应用:
(1)大片段基因敲入小鼠模型构建。作者首先在小鼠受精卵Actb位点用P2A-EGFP做了一个reporter KI测试,结果显示RED-CRISPR mRNA组(18.0%)较Cas9 mRNA组(6.9%)显著提升了EGFP+囊胚比例。随后,作者分别在CaMKII和H11位点进行大片段基因敲入以制备大片段KI小鼠模型。以H11位点knock-in一个8 kb的大片段为例:Cas9 mRNA组出生的41只幼鼠中只有1只是正确的KI(2.44%),而RED-CRISPR mRNA组出生的67只幼鼠中有29只是正确的KI(43.28%),效率提升了17倍。作者在制备基因敲入小鼠模型时还将金斯瑞公司Cas9 mRNA、NEB公司Cas9蛋白等改造过的商品化基因编辑酶与RED-CRISPR进行了平行比较,结果均显示RED-CRISPR mRNA的效率提升和安全性是最高的。
(2)高效CAR-T细胞制备。作者选择在T细胞TRAC位点敲入约2 kb的2A-CAR-pA表达盒来制备CAR-T细胞。使用质粒形式递送时,Cas9组的平均CAR阳性率约为4.7%,RED-CRISPR组提升至11.7%;使用mRNA形式递送时,Cas9组的CAR阳性率约为27.7%,RED-CRISPR组提升到44.3%。体外杀伤CD19+ NALM-6细胞时,在E:T=3:1条件下,Cas9组和RED-CRISPR组制备的CAR-T细胞都能高效清除NALM-6细胞,而在1:1和1:3低效靶比条件下,RED-CRISPR生成的CAR-T细胞杀伤更彻底。安全性:在使用相同TRAC gRNA的条件下,Cas9组检测到20个脱靶事件,RED-CRISPR组只检测到1个脱靶事件,染色体易位总比例也从~1.24%降到~1.00%。
(3)疾病的突变位点纠正。β-地中海贫血/镰刀型贫血患者体内,HBB有>200种致病突变,分布在3个外显子上,很难一一设计gRNA和donor。在镰刀型贫血患者来源的iPS细胞中,作者设计了两个sgRNA切掉HBB外显子1-3区域,并用一个完整的HBB cDNA做“整体替换”(knock-in长度约为2.2 kb)——这种方式对大多数HBB突变都有潜在适用性。结果显示,阳性iPS克隆中,致病位点的“Val”被成功改回“Glu”。此外,多能性marker染色结果显示,RED-CRISPR编辑后iPS细胞的多能性未受影响。
综上所述,RED-CRISPR系统是一种高效精准的大片段基因敲入方法,在大片段基因敲入动物模型构建、CAR-T免疫疗法以及病源突变位点校正等方面具有广泛的应用价值。
鲍坚强研究员、王成坤教授、程临钊教授、刘洪彬教授和张友明教授为本文的共同通讯作者。本研究得到了中国科学技术大学生命科学与医学部史庆华教授、薛天教授、合肥星眸生物科技有限公司才源博士、中国科学技术大学生命科学与医学部实验动物中心岳挺博士、斯坦福大学丛乐教授以及赛业(苏州)生物科技有限公司的大力支持与帮助。该研究得到了国家自然科学基金、合肥综合性国家科学中心大健康研究院和安徽省自然科学基金等项目的支持。
另外,2026年1月23日,中国科学技术大学鲍坚强课题组与南京医科大学王成坤课题组在Nucleic Acids Research杂志发表了题为“Compact bacterial recombination complexes drive efficient kilobase-scale knock-in in mammalian cells”的研究论文,报道了另一种基于RecE/T介导的千碱基级DNA敲入技术。原文链接:https://doi.org/10.1093/nar/gkag020
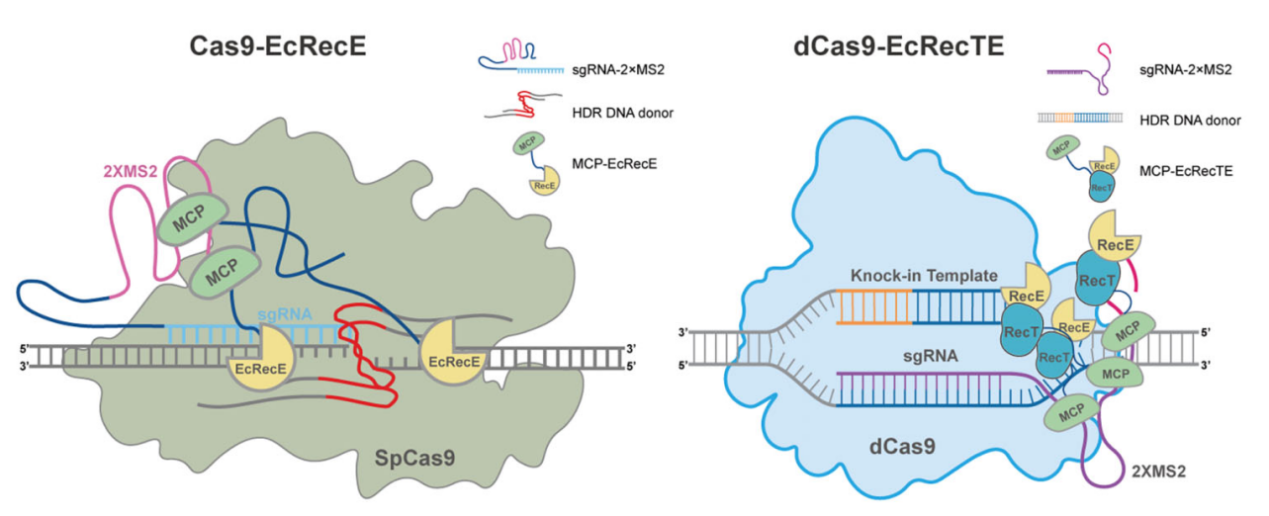
与Redα/β 系统相似,RecE/T系统是Rac原噬菌体中一种高效同源重组系统,其包括RecE和RecT两个蛋白,其中RecE为外切酶,RecT是单链DNA退火蛋白。RecE/T系统与Redα/β系统具有相似的同源重组机制。
在该项研究中,作者筛选到EcRecE可作为一种高效的HDR增强因子,评估了Cas9/EcRecE偶联系统在不同细胞系和原代细胞中的HDR增强能力,并对该系统进行了进一步优化和安全性评估。结果显示:EcRecE可将各类细胞中的HDR效率提高2-4倍,并且与单独使用Cas9相比具有更高的精准性。作者随后结合蛋白质工程获得了尺寸最短但效率最高的RecE变体。结合课题组之前开发的REDIT和dCas9-SSAP技术(Wang et al., 2021,Nucleic Acids Research; Wang et al., 2022, Nature cell biology),作者将截短的RecE与RecT融合,分别构建了Cas9-miniRecE/T、Cas9n-miniRecE/T和dCas9-miniRecE/T系统。结果表明,这些系统均可在细胞中实现高效大片段基因敲入。其中,dCas9-miniRecE/T系统能够在不形成DNA单链/双链断裂的条件下实现高于野生型Cas9的基因敲入效率,这对于精准基因治疗具有重要意义。最后,作者将miniRecE/T系统应用于人类胚胎干细胞和小鼠原代神经元。另外,由于miniRecE/T尺寸很小,作者将其与Cas9一起包装到腺病毒,并在多个细胞内源性位点实现高效大片段DNA敲入。
鲍坚强研究员、王成坤教授和韩峰教授为本文的共同通讯作者。本研究得到了斯坦福大学丛乐教授的支持与帮助。该研究得到了国家自然科学基金、合肥综合性国家科学中心大健康研究院和安徽省自然科学基金等项目的支持。
