非整倍体是人类肿瘤细胞中最普遍的特征,约90%的肿瘤的基因组是非整倍体,而正常细胞是二倍体1,找到针对非整倍体肿瘤的特异性靶点,是实现精准杀死肿瘤细胞而不影响正常二倍体细胞的有效策略。非整倍性是一把双刃剑:一方面可以促进肿瘤的增殖、转移和抗药性的产生2;另一方面也会给肿瘤细胞带来多方面的压力,例如复制压力、代谢压力、蛋白表达及有丝分裂压力3。其中代谢压力包括由于线粒体功能障碍等多种原因造成的过量活性氧(ROS)积累;有丝分裂压力是非整倍体肿瘤细胞分裂期需要排列更多的染色体,并及时纠正更多的动粒-微管错误连接,确保染色体及时精准分离。因此当非整倍体肿瘤细胞分裂时将会面临氧化和有丝分裂双重压力,而其如何成功应对这些压力的机制尚不清楚,揭示背后的调控机理对于发现非整倍体肿瘤特异性干预靶点有重要的意义。

2023年6月22日,中国科学技术大学杨振业课题组在Nature Metabolism杂志上发表了题为A mitotic NADPH upsurge promotes chromosome segregation and tumor progression in aneuploid cancer cells的文章,该研究深入地探究了非整倍体肿瘤细胞在分裂期氧化还原状态以及调控机制,发现了核心代谢物NADPH在细胞周期中的变化规律和在有丝分裂期的调控机制,证明了该信号在确保染色体准确分离和维持基因组完整性中的重要功能,从而揭示了非整倍体肿瘤细胞在分裂期特异的代谢调控通路,为临床通过干预代谢通路选择性抑制非整倍体肿瘤提供了新的标记物和治疗新思路。
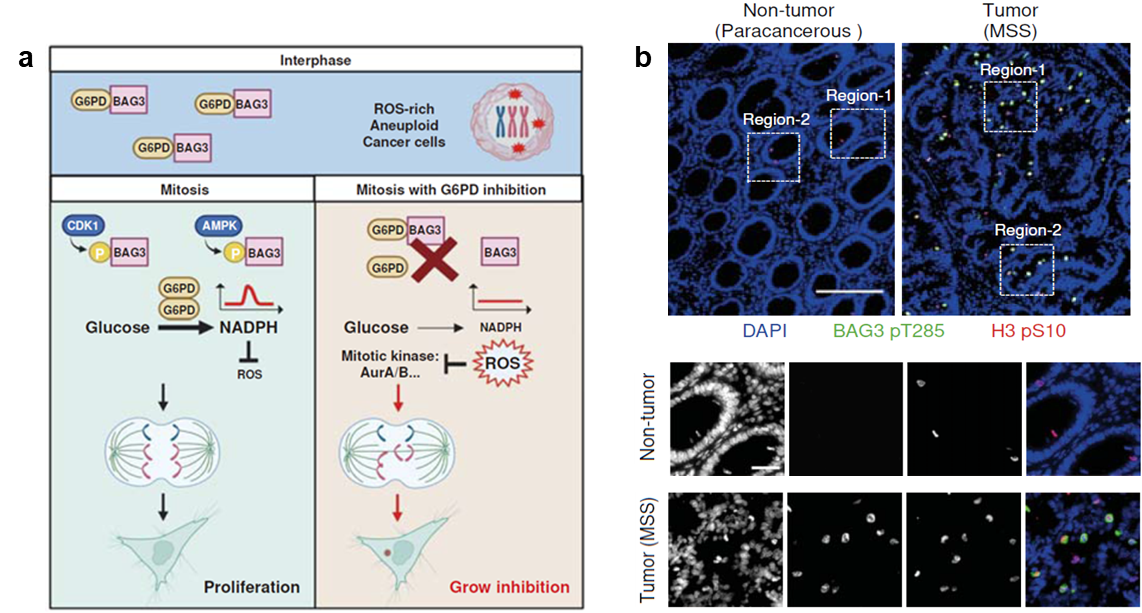
首先研究人员利用华东理工大学杨弋、赵玉政教授和中科大刘海燕教授联合开发的遗传编码的NADPH探针4对多种肿瘤细胞进行了连续的活细胞观察,发现在细胞有丝分裂时,会发生明显的NADPH上调。NADPH在分裂期的动态变化只发生在非整倍体肿瘤细胞中,近二倍体的肿瘤细胞并没有这个现象。接着通过筛选寻找到了促进分裂期NADPH上调的关键代谢酶G6PD。抑制分裂期G6PD活性,阻止NADPH的上升,将会导致分裂期ROS显著上升,有丝分裂发生阻滞,染色体错误分离的概率增加。通过蛋白组筛选和位点特异性磷酸化抗体的鉴定,作者进一步解析了调控分裂期G6PD酶活性的上游信号,即非整倍体肿瘤细胞在有丝分裂时,CDK1联合AMPK将G6PD酶活性的负调因子-BAG3的285位苏氨酸磷酸化,导致BAG3和G6PD复合体解离,促进G6PD的二聚化,从而增强了分裂期G6PD的酶活性。通过磷酸化组学和突变分析发现分裂期快速产生的NADPH降低了细胞内的活性氧,避免Aurora激酶活性口袋中保守的Cys发生次磺酸化修饰而失活5,从而避免包括Aurora在内的分裂期激酶失活引起的染色体分离错误、微核产生和免疫活化(图a),促进了细胞周期进程和肿瘤增殖。
最后作者还检测了一系列的结肠癌样本,发现BAG3 T285磷酸化在微卫星不稳定型(多数为近二倍体)样本中比率低,在微卫星稳定型(多数为非整倍体)结肠癌样本中比率高(图b),且和病人的预后密切相关。该研究揭示了一种新的非整倍体肿瘤细胞维持基因组稳定性的保护机制,为靶向G6PD治疗相关非整倍体肿瘤提供了新的思路和启示。
中国科学技术大学生命科学与医学部杨振业教授和中国科学技术大学附属第一医院国静副研究员为该论文的共同通讯作者,副研究员程傲星和博士研究生徐添为该论文的共同第一作者。中国科学技术大学姚雪彪教授、王育才教授、张海燕老师、附属第一医院张开光教授、刘流教授、香港浸会大学史珏教授、国家生物医学中心潘欣教授、安徽农业大学郭慧敏老师、中科大研究生尤伟屹、王婷和张东明参与了该工作。研究还得到了华东理工大学赵玉政、杨弋教授、中国科学技术大学张华凤教授和首都医科大学李兵辉教授的大力帮助。研究得到了科技部国家重点研发计划、基金委糖脂代谢重大研究计划、教育部高校基础研究基金、中科院先天免疫与慢性病重点实验室开放课题和合肥科学中心大健康研究院等项目的联合资助。
原文链接:https://www.nature.com/articles/s42255-023-00832-9
Nature Briefing同步在线发表题为NADPH increase during mitosis in aneuploid tumor cells protects against genomic aberrations的研究简报。
链接:https://www.nature.com/articles/s42255-023-00848-1
参考文献:
1 Gordon, D. J., Resio, B. & Pellman, D. Causes and consequences of aneuploidy in cancer. Nat Rev Genet13, 189-203, doi:10.1038/nrg3123 (2012).
2 Ippolito, M. R. et al. Gene copy-number changes and chromosomal instability induced by aneuploidy confer resistance to chemotherapy. Dev Cell56, 2440-2454 e2446, doi:10.1016/j.devcel.2021.07.006 (2021).
3 Zhu, J., Tsai, H. J., Gordon, M. R. & Li, R. Cellular Stress Associated with Aneuploidy. Dev Cell44, 420-431, doi:10.1016/j.devcel.2018.02.002 (2018).
4 Zou, Y. et al. Analysis of redox landscapes and dynamics in living cells and in vivo using genetically encoded fluorescent sensors. Nat Protoc13, 2362-2386, doi:10.1038/s41596-018-0042-5 (2018).
5 Byrne, D. P. et al. Aurora A regulation by reversible cysteine oxidation reveals evolutionarily conserved redox control of Ser/Thr protein kinase activity. Sci Signal13, doi:10.1126/scisignal.aax2713 (2020).
