组蛋白去乙酰化酶(Histone deacetylases,HDACs)是进化上保守的酶,可以去除组蛋白上的乙酰化修饰,并在表观遗传基因沉默中发挥核心作用[1]。HDACs大家族根据与酵母中序列同源性和结构域组织差异可分为四类,其中I类HDAC被广泛研究,因为其是多种疾病(癌症、炎症、感染和神经系统疾病等)的表观遗传治疗非常有希望的靶点[2]。酿酒酵母中的Rpd3是I类HDAC的创始成员,它在体内可以形成两种不同的复合物:在启动子区域去乙酰化组蛋白的~ 1.2 MDa Rpd3L,以及靶向转录区域抑制基因转录起始的~ 0.6 MDa Rpd3S[3,4]。Rpd3S由三个核心蛋白:Rpd3、Sin3和Ume1以及两个染色质结合亚基:Eaf3和Rco1组成[5,6]。在高等真核生物中,额外的组成亚基以及类似物和异构体的存在进一步增加了HDAC复合物的异质性,限制了我们对这些复合物结构和功能的理解。
2023年10月16日,中国科学技术大学生命科学与医学部王雪娟、蔡刚教授团队合作在Cell Research(IF=44)期刊上在线发表了题为Structural basis for nucleosome binding and catalysis by the yeast Rpd3S/HDAC holoenzyme的研究论文。该研究利用冷冻电镜技术解析了Rpd3S/HDAC全酶复合物结合H3K36me3修饰核小体底物复合物的高分辨结构,首次清晰捕获了结合在Rpd3S/HDAC活性中心的天然催化底物--组蛋白H3尾部(1-24氨基酸残基),并意外地发现了H3K18残基的侧链对准HDAC催化残基等待催化;并通过功能手段进一步验证了结构上的发现,尤其是Rco1亚基N端结构域在核小体底物结合和活性精准调控中起到的关键作用。

早在2005年Jerry Workman团队已经清晰鉴定了Rpd3S复合物的5种亚基组成[3],但是由于其整体蛋白分子结构柔性较大,为其高分辨结构的解析带来了很大的难度。酵母Rpd3S复合物相关结构及其人类同源物Sin3B复合物的结构直到近期才被报道[7-9]。然而,Rpd3S如何识别和催化底物,及其HDAC活性精细调控的结构基础和分子机制尚不清楚。
为了回答这个重要的科学问题,该研究团队首先通过大规模培养酵母细胞和内源性蛋白纯化获得了高度均一的Rpd3S复合物蛋白,优化并组装了最佳单核小体底物(H3K36me3修饰;仅在核小体一端伸出70bp linker DNA)。在不引入任何化学交联剂干扰的情况下,成功体外组装了Rpd3S-核小体复合物,解析了3.7 Å分辨率的复合物结构(图1)。
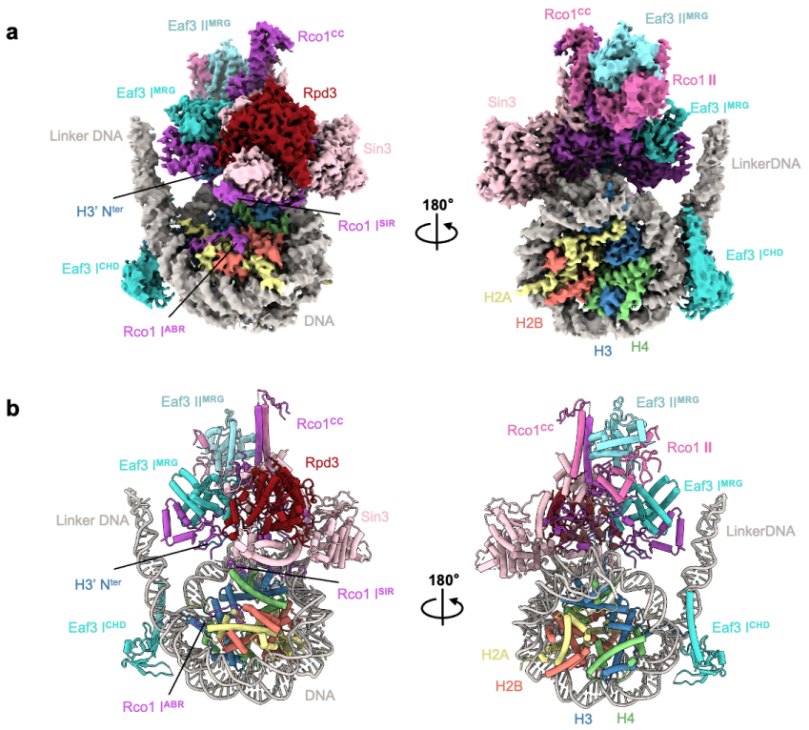
图1. Rpd3S结合H3K36me3修饰的核小体的整体结构
该结构揭示了Rpd3S包含两个Rco1和两个Eaf3拷贝,它们通过Rco1 C-端卷曲区域(CC)进行二聚化,Eaf3 CHD结构域识别H3K36me3标记并与核小体DNA相互作用。Sin3作为支架蛋白和Rco1亚基一起协调了复合物的组装,并通过其HID、MD和CTD结构域包裹住催化亚基Rpd3;同时,Sin3-DNA、Rco1-linker DNA结合界面共同帮助引导Rpd3S精准锚定在核小体底物上。
Rco1 N端的ABR结构域通过R61和K64残基直接锚定在组蛋白的酸性斑块的表面,并通过R50和R51残基在SHL -6.5处与核小体DNA结合。此外,Rco1 PHD1结构域的D261侧链直接与H3K4me0相互作用、参与底物的识别;而Rco1 PHD2结构域与Rpd3相互作用参与复合物整体结构的组装和稳定。
H3K18Ac是癌症进展的重要标志,也是抗癌治疗的潜在靶点[10],该结构首次解析了完整的天然底物H3尾巴(1-24 aa)结合在活性中心的结合状态,并且H3K18残基朝向催化中心。这些结构上的重要发现,被体外的功能实验进一步地得到证实。
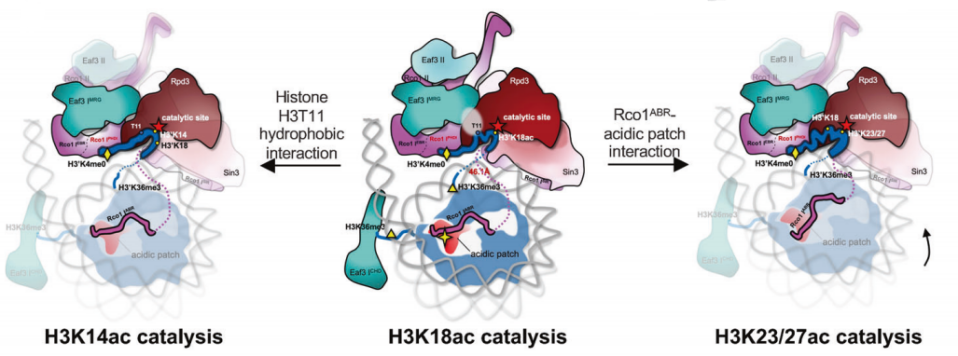
图2. Rpd3S如何选择和催化H3尾部多个特定赖氨酸残基的机制
该研究报道了Rpd3S全酶结合和催化核小体底物的结构基础,清晰揭示了Rpd3S全酶底物识别特异性和催化复杂性(图2),阐明了Rpd3S通过构象变化实现组蛋白多位点催化的机制,为研制高特异性Rpd3S/Sin3B抑制剂用于癌症治疗提供了新的靶点。
这项工作是在中国科学院战略先导B专项和国家自然科学基金项目的资助下完成的;中国科大生医部王雪娟教授和蔡刚教授为该论文的共同通讯作者,博士生张跃跃和博士后徐梦雪为该论文的共同第一作者,研究生王坡、周佳慧、王光显和韩帅龙参与了部分工作。数据收集在中国科学技术大学冷冻电镜中心完成。此外,该研究还得到了清华大学李海涛、陈柱成教授,中国科大臧建业、施蕴渝教授的大力帮助。
原文链接:
https://www.nature.com/articles/s41422-023-00884-2
参考文献
Goldberg, A. D., Allis, C. D. & Bernstein, E. Epigenetics: a landscape takes shape. Cell 128, 635-638 (2007).
Luo, Y. & Li, H. Structure-Based Inhibitor Discovery of Class I Histone Deacetylases (HDACs). Int J Mol Sci 21 (2020).
Carrozza, M. J. et al. Histone H3 methylation by Set2 directs deacetylation of coding regions by Rpd3S to suppress spurious intragenic transcription. Cell 123, 581-592 (2005).
Keogh, M. C. et al. Cotranscriptional set2 methylation of histone H3 lysine 36 recruits a repressive Rpd3 complex. Cell 123, 593-605 (2005).
Chen, X. F. et al. The Rpd3 core complex is a chromatin stabilization module. Current biology : CB 22, 56-63 (2012).
Li, B. et al. Combined action of PHD and chromo domains directs the Rpd3S HDAC to transcribed chromatin. Science 316, 1050-1054 (2007).
Wan, M. S. M. et al. Mechanism of assembly, activation and lysine selection by the SIN3B histone deacetylase complex. Nature communications 14, 2556 (2023).
Wang, C. et al. Two assembly modes for SIN3 histone deacetylase complexes. Cell Discov 9, 42 (2023).
Guan, H. et al. Diverse modes of H3K36me3-guided nucleosomal deacetylation by Rpd3S. Nature (2023).
Halasa, M. et al. H3K18Ac as a Marker of Cancer Progression and Potential Target of Anti-Cancer Therapy. Cells 8 (2019).
