哺乳动物线粒体核糖体rRNA(mt-rRNA)的修饰对于线粒体核糖体组装,线粒体正常行使功能是必不可少的,与人类疾病有着越来越密切的关联,然而线粒体疾病很多分子机理尚不清楚。研究表明甲基转移酶 (METTL) 家族的 METTL15甲基转移酶参与了人线粒体的12S rRNA helix44上的m4C839修饰。在大肠杆菌核糖体中,等效位置m4C839修饰位于mRNA的p位点密码子附近,推测其在微调p位点和提高解码保真度方面发挥作用。METTL15定位于人线粒体中,敲除METTL15会导致12S rRNA中m4C839水平显著降低,进而导致线粒体功能障碍。hsRBFA作为mt-SSU组装因子,可以结合在mt-12S rRNA的3’-末端的发夹结构处(helix44和helix45)。hsRBFA可以帮助甲基转移酶TFB1M完成对12S rRNA helix45上两个连续腺嘌呤的甲基化修饰(m.A937-m.A938)。随后招募甲基转移酶METTL15完成12S rRNA helix44的 m4C839修饰,进一步确保线粒体核糖体小亚基正确组装。
为了阐明METTL15、hsRBFA和12S rRNA相互作用的分子机制以及METTL15在线粒体基因表达中的调控作用,在本研究中,研究人员分别解析了甲基转移酶METTL15单体,METTL15与甲基供体SAM二元复合物,METTL15-SAM-hsRBFA三元复合物以及METTL15-SAM-hsRBFA-12S rRNA四元复合物的晶体结构。结构分析表明,METTL15由MTase结构域和scaffold-like结构域组成,通过相对保守口袋识别甲基供体SAM。与此同时,hsRBFA通过其C端helix与METTL15 scaffold-like结构域一侧的疏水表面结合,而底物RNA则结合在scaffold-like结构域的另一侧。进一步通过突变、ITC、FP等实验鉴定了METTL15分别与hsRBFA,RNA形成特异性识别的关键残基,也表明了hsRBFA可能是将METTL15招募到线粒体核糖体小亚基的关键因素,而不是12S rRNA(图1)。
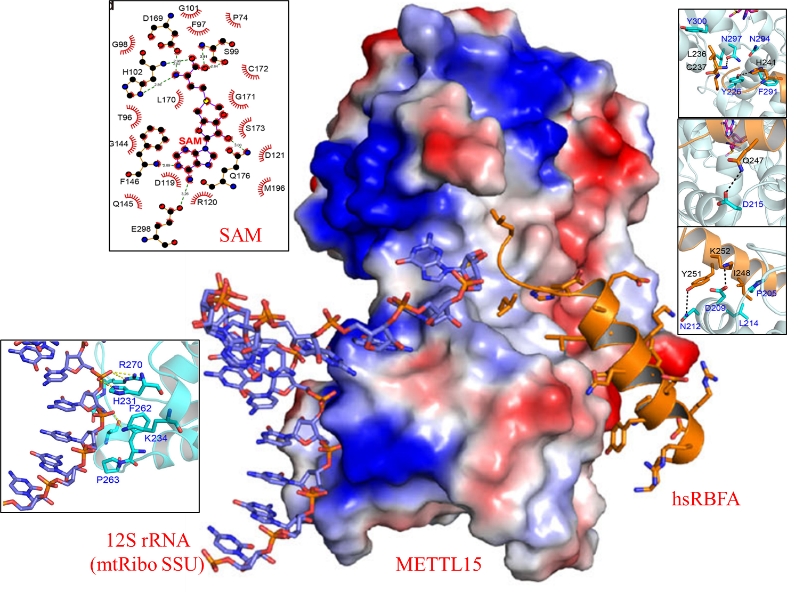
图1. METTL15底物识别及12S rRNA-hsRBFA招募METTL15的分子机制
除此以外,研究人员发现,在293T细胞中敲低METTL15,不仅影响到线粒体核糖体编码的13个蛋白质的翻译水平,同时会影响线粒体OXPHOS活性和细胞代谢路径,例如线粒体的ROS水平均大幅上升,线粒体的膜电位下降,线粒体的有三羧酸循环水平下降,糖酵解水平代偿性上升。非靶向代谢组学以及WB的分析也进一步表明,METTL15敲低细胞系中无氧呼吸水平上升会导致细胞内乳酸分泌水平上调,从而影响核基因组的组蛋白乳酰化修饰水平变化(组蛋白H4K12-la 和H3K9-la修饰水平上调)(图2)。
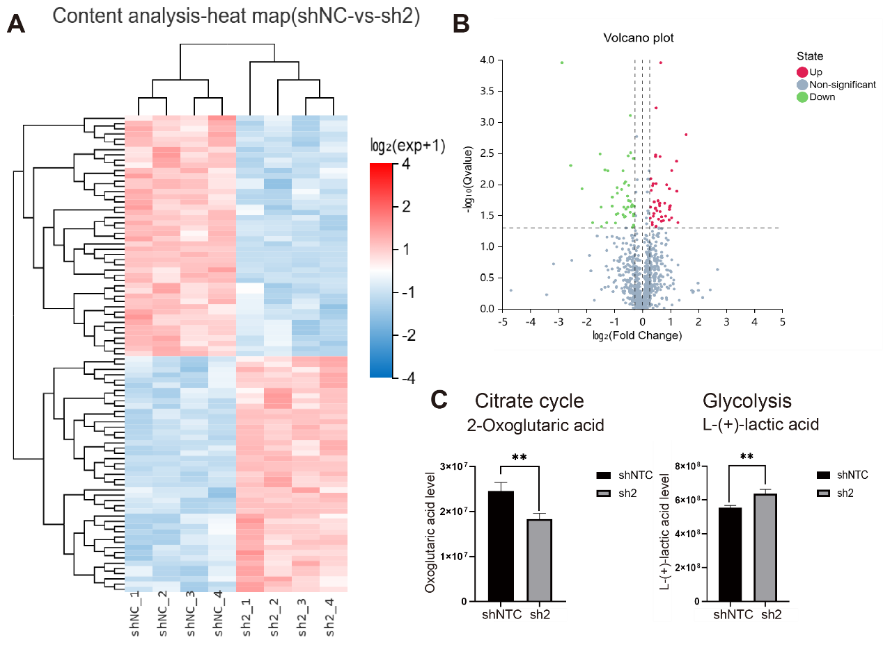
图2. METTL15的敲低造成的细胞代谢路径改变,乳酸水平升高的改变
该研究综合利用结构生物学,生物化学和细胞生物学的方法,系统深入的分析了甲基转移酶METTL15与各底物之间的识别机制,探讨了METTL15的缺失对线粒体功能和细胞代谢的影响,还进一步探究了线粒体代谢产物对核基因组表观遗传调控的影响。为METTL15在线粒体基因表达中的表观遗传调控作用提供了新的见解,同时也为后续的线粒体中其他甲基转移酶的结构和功能研究提供更多的参考。
中国科学技术大学生医部特任副研究员吕梦琪和博士生周婉婉为本文的共同第一作者。中国科学技术大学生医部特任副研究员张亮和吕梦琪为本文的共同通讯作者。本研究得到细胞动力学教育部重点实验室、微尺度国家研究中心和合肥综合性国家科学中心大健康研究院的大力支持,以及科技部、国家自然科学基金、中国科学院战略性先导项目、博新计划等项目的资助,中国科大姚雪彪教授、张华凤教授、张家海教授为该工作的顺利开展提供了大力支持。
原文链接:https://doi.org/10.1038/s41421-023-00634-z
