肿瘤微环境通过免疫抑制因子失衡、代谢异常及物理屏障等多种机制形成多重免疫抑制屏障,导致自然杀伤(NK)细胞治疗面临活性抑制、浸润不足和功能耗竭等关键挑战。突破微环境障碍以增强免疫系统对癌症的免疫应答,是增强NK细胞免疫疗效的核心问题。近年来,免疫检查点治疗已经成为一种有效的肿瘤免疫疗法。此外,科研人员也正在研究使用小分子化合物来突破微环境障碍,以实现将“冷肿瘤”转化为“热肿瘤”状态进而提高免疫疗效。
小分子化合物因其高口服生物利用度、能够深入肿瘤微环境以及有效穿过细胞膜作用于细胞内靶点等特性,成为增强免疫治疗的重要武器。靶向蛋白降解技术(Targeted Protein Degradation, TPD)通过独特的“占位驱动”机制实现对靶点的特异性降解。其核心理念是形成目标蛋白-PROTAC-E3泛素连接酶三元复合物,利用细胞自身的蛋白质降解机制(如蛋白酶体途径)来实现对靶点的降解性抑制。PROTACs具有循环利用、低剂量用药、靶向不可成药靶点以及增强对靶点选择性的独特优势,从而显著提高了药物的安全性并有效降低了毒副作用。因此,这提示PROTACs可在肿瘤免疫治疗领域具有广阔前景。

2025年2月10日,中国科学技术大学生命科学与医学部、免疫应答与免疫治疗全国重点实验室王毅课题组在Cell子刊Molecular Therapy在线发表了题为“A BPTF-specific PROTACdegrader enhances NK cell-based cancer immunotherapy”的研究论文。本研究首先确定了肝癌细胞中高表达的BPTF作为治疗肝细胞癌(HCC)的潜在靶点,并揭示了BPTF的PHD finger通过识别H3K4me3修饰经表观遗传调控促进硫酸乙酰肝素酶(HPSE)表达的具体机制。鉴于目前缺乏针对PHD finger的有效抑制剂,本研究设计了一种能够特异性诱导BPTF降解的PROTAC靶向降解剂8d。该化合物通过利用肝癌细胞自身的泛素-蛋白酶体系统降解BPTF,从而抑制HPSE的表达。这一过程增加了肝癌细胞表面硫酸乙酰肝素蛋白聚糖(HSPGs)的丰度,进而增强了NK细胞表面自然细胞毒性受体(NCRs)对肿瘤细胞的识别与杀伤。因此,PROTAC 8d最终改变了肿瘤免疫逃逸的微环境,使肝癌细胞重新暴露于免疫监视之下,显著增强了NK细胞对肝癌的杀伤效应(见图1)。
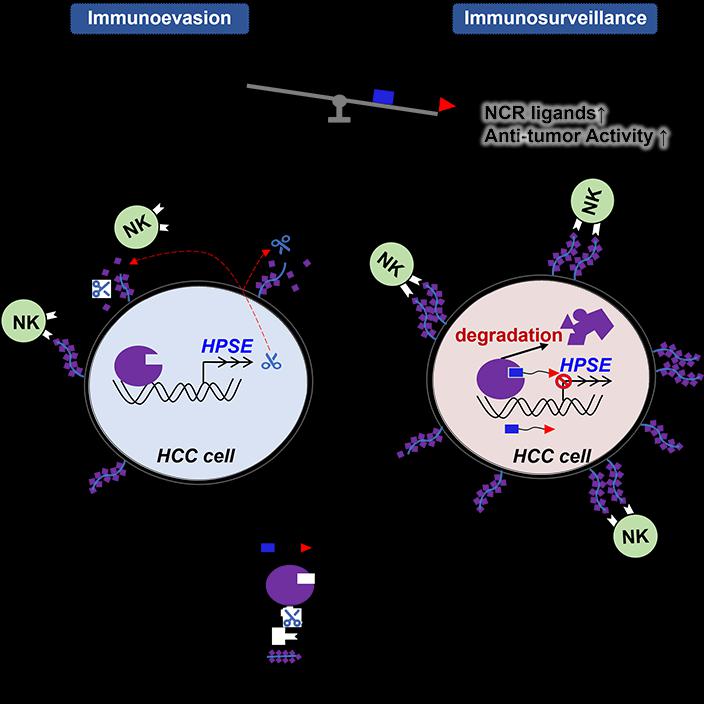
图1 BPTF降解剂PROTAC 8d增强NK细胞抗肝癌效应。BPTF促进肝细胞癌(HCC)细胞表达硫酸乙酰肝素酶(HPSE),该酶分泌到肿瘤微环境中,消解细胞膜上的硫酸乙酰肝素蛋白聚糖(HSPGs),从而阻碍NK细胞表面活性受体NCRs对其识别(图1左)。BPTF靶向降解剂8d可特异性诱导HCC细胞内BPTF的降解,抑制HPSE的表达,增加HCC细胞表面HSPGs的丰度,从而增强NK细胞对HCC细胞的识别能力,最终增强NK细胞的抗肝癌效应(图1右)。
综上所述,PROTAC 8d通过利用泛素-蛋白酶体系统选择性降解HCC中的潜在靶点BPTF,展现出高选择性和低毒性。值得注意的是,PROTAC 8d本身不直接诱导细胞凋亡。与传统PROTACs通过直接诱导肿瘤细胞凋亡的机制不同,PROTAC 8d通过降低肿瘤微环境免疫抑制因子,进而增强肝癌细胞的免疫原性,实现从“冷肿瘤”到“热肿瘤”的转换,从而激活NK细胞对肝癌的杀伤作用。本研究不仅将PROTAC技术成功拓展至肿瘤免疫治疗领域,还为基于NK细胞的肿瘤免疫治疗提供新的研究思路。
中国科学技术大学生命科学与医学部博士生李昀佳、梁浩、颜培栋、复旦大学博士后白琳、中国科大附属第一医院陈浩副主任医师、科研助理曹灼贤为该论文的共同第一作者。中国科学技术大学免疫应答与免疫治疗全国重点实验室王毅研究员、金晶副研究员、复旦大学人类表型组研究院丁琛教授为该论文的通讯作者。该研究工作获得了中国科学技术大学免疫应答与免疫治疗全国重点实验室魏海明教授、梅一德教授、香港大学医学院郝权教授、贵州医科大学何彬教授、中国科大附属第一医院黄玫副研究员等合作团队的大力支持,以及中国科学院战略性先导科技专项B类、国家自然科学基金、国家重点研发计划、安徽省自然科学基金、合肥综合性国家科学中心大健康研究院全球遴选项目-创新药物等项目资助。
原文链接:https://www.sciencedirect.com/science/article/pii/S1525001625001030?via%3Dihub
