细胞在生命活动中持续面临内质网应激、氧化应激、热休克及营养匮乏等多种内外源性应激,并触发包括蛋白质泛素化网络动态重塑、代谢途径重编程和应激响应的mRNA剪接体(stress-responsive mRNA isoform, SR-mRNAiso)产生在内的复杂应激响应机制,以维持细胞稳态或调控细胞命运决策。然而除经典的XBP1s剪接体外,其他SR-mRNAiso在细胞应激响应中是否参与调控关键生理病理功能的研究仍缺乏系统深入探索。与此同时,应激相关代谢疾病的发病率正显著上升,已成为全球公共卫生领域的重大挑战,其中作为典型代谢紊乱性疾病的非酒精性脂肪肝病(NAFLD),在进展至严重阶段-非酒精性脂肪性肝炎(NASH)时,常表现出脂质稳态失衡、葡萄糖代谢异常等多种代谢紊乱的病理特征,且尽管 NASH 的疾病负担日益加剧,目前仍缺乏经 FDA 或其他监管机构批准的针对性治疗药物,这一现状凸显了该领域存在的重大临床需求。
近日,中国科学技术大学生命科学与医学部陈亮研究员、单革教授和王小林副研究员团队在Nature Communications在线发表题为“A UFD1 variant encoding a microprotein modulates UFD1f and IPMK ubiquitination to play pivotal roles in anti-stress responses”的研究论文,鉴定出哺乳动物保守的应激响应剪接体UFD1s(spliced UFD1),并揭示其编码的微蛋白通过调节泛素融合降解蛋白UFD1f(full-length UFD1)及下游关键因子肌醇多磷酸激酶IPMK的泛素化修饰,进而影响自噬和脂肪酸氧化(FAO)代谢通路的作用机制。研究还发现UFD1s表达可显著延缓NASH进展,为代谢性肝病治疗提供了新靶点。

为深入探究哺乳动物细胞在应激条件下可变剪接的动态调控,研究人员通过高通量测序与实验验证,系统分析了在葡萄糖缺乏诱导的代谢氧化应激及毒胡萝卜素诱导的内质网应激两种压力条件下人和小鼠细胞系中剪接体的表达变化。该研究发现UFD1s作为一种应激响应的UFD1 mRNA剪接体,在正常生理状态下呈低水平表达,而在多种细胞应激条件下表达显著上调,且该调控模式在哺乳动物中具有高度保守性。通过结合eCLIP-seq数据分析与实验验证,揭示剪切因子AQR和U2AF65在调控UFD1s生成中的关键作用。进一步蛋白免疫检测证实UFD1s能够翻译产生功能性微蛋白(人源50 AA/鼠源58 AA)。功能实验表明,在生理状态下,UFD1s通过维持细胞内ROS稳态、增强线粒体呼吸功能来促进细胞生长,提示其基础表达水平对消除内源性代谢应激及维持线粒体正常功能至关重要;而在应激条件下,UFD1s通过显著降低ROS水平,促进ATP生成进而增强细胞存活能力,体现了其在细胞应激保护中的关键作用。进一步的研究发现UFD1s通过调控自噬和脂肪酸氧化(FAO)两条关键代谢通路发挥其生物学功能。
通过免疫沉淀联合质谱分析,研究人员证实UFD1s能够竞争性结合E3泛素连接酶MARCH7,从而特异调控UFD1f 蛋白K240和K280位点的K63多聚泛素化修饰。值得注意的是,UFD1s的表达显著降低了细胞内总蛋白的泛素化水平。基于泛素组学系统分析及实验验证,研究人员发现UFD1s调控多种应激反应和代谢相关蛋白的泛素化修饰,其中IPMK的泛素化水平变化最为显著。深入机制研究表明,UFD1s通过介导UFD1f 的K63多聚泛素化修饰,特异性调节IPMK的K48和K11多聚泛素化的相对比例,进而影响其蛋白稳定性。作为UFD1s的关键下游效应分子,IPMK通过双重机制影响细胞代谢稳态:一方面直接抑制自噬活性;另一方面通过抑制FAO促进脂质累积。进一步研究发现,IPMK的这些代谢调控功能均依赖于其对AMPK信号通路的抑制作用,从而揭示了UFD1s-UFD1f-IPMK-AMPK这一全新的代谢轴在细胞应激反应中的核心作用。
研究发现,UFD1s缺失小鼠表现出显著的代谢紊乱,表现为总能量消耗降低,肝脏细胞ROS水平升高、ATP水平下调,自噬活性抑制及FAO功能障碍导致的脂质异常累积。在NASH小鼠模型中,研究人员发现UFD1s缺失显著加速疾病进展,表现为血清学指标异常,以及肝脏病理改变加剧。临床样本分析进一步显示,NASH患者肝脏组织中UFD1s蛋白表达显著下调,提示其与NASH发生发展存在密切关联。基于此,研究人员利用两种递送策略(肝脏特异性表达质粒和环形RNA载体)在NASH小鼠中表达UFD1s,结果显示治疗组小鼠表现出显著的代谢和病理学改善:血清生化检测显示甘油三酯、总胆固醇和AST水平显著降低;肝脏脂肪变性程度减轻、脂滴沉积减少、纤维化及炎症程度减轻,同时伴随IPMK表达下调和自噬通路激活。该研究不仅阐明了UFD1s通过调控IPMK介导的自噬和脂质代谢进而延缓NASH进展的分子机制,同时揭示了其作为NASH治疗靶点的潜在医学价值。
该研究首次在动物细胞中发现可变剪接来源的微蛋白UFD1s,其可通过干扰全长同源蛋白UFD1f的功能发挥调控作用。这一发现突破了既往仅在植物中发现小干扰肽(small interfering peptide)的认知局限,证实了动物细胞中也存在类似的功能性小干扰肽调控机制。
综上所述,该研究发现了哺乳动物细胞中一种保守的、具有抗应激功能的微蛋白UFD1s。该蛋白通过动态调控关键因子的泛素化修饰,促进自噬和脂质代谢。这一发现不仅揭示了细胞应激响应的新调控机制,还为包括NASH在内的代谢性疾病的治疗提供了潜在的新靶点和治疗策略。
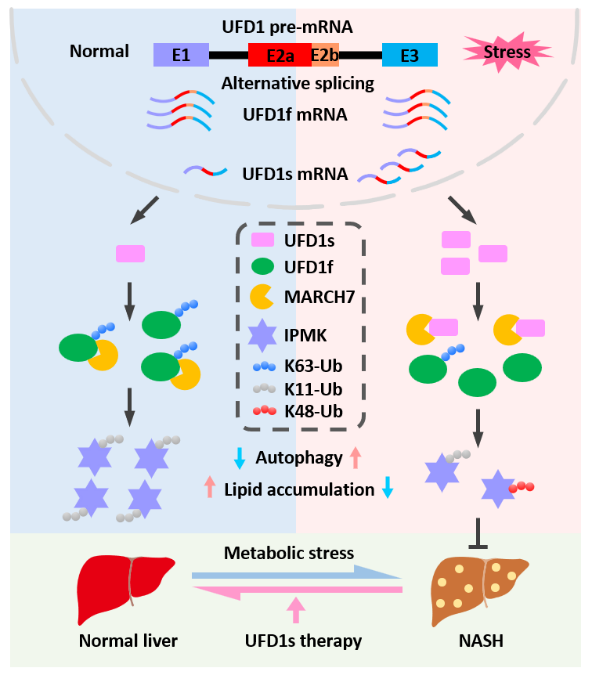
UFD1s在抗应激反应中的功能与作用机制示意图
中国科学技术大学李秀芝博士后和王小林副研究员为文章共同第一作者。陈亮研究员、单革教授和王小林副研究员为本文共同通讯作者。该研究得到了香港中文大学附属第二医院林文楚教授、中国科大生医部蔡刚教授、梅一德教授、仓春雷教授、郑小虎教授及中国科大附一院孟凡征博士的大力支持。该研究获得国家基金委、安徽省科技厅、安徽省教育厅、中国科学技术大学、以及合肥综合性国家科学中心前沿交叉科学与生物医学研究所的基金项目的资助。
论文链接:https://www.nature.com/articles/s41467-025-62073-6
