2025年9月2日,Nature Plants杂志在线发表了中国科学技术大学生命科学与医学部孙林峰、刘欣团队联合物理学院张志勇团队的重要研究成果,论文题为“Structural basis of CAX1 autoinhibition by its amino-terminal domain in Arabidopsis thaliana”。该研究解析了模式植物拟南芥中钙离子/质子反向转运蛋白CAX1在自抑制状态和模拟磷酸化激活状态下的结构,揭示了其依赖于氨基端(N端)结构域的自抑制机制及受磷酸化修饰激活的分子基础,填补了植物钙信号转导和钙稳态维持研究中的关键空白。
钙离子作为植物体内关键的第二信使,广泛参与信号传导和生理过程,尤其在植物应对环境变化时,胞质Ca2+浓度的时空动态调控至关重要。拟南芥 CAX1 (Ca2+/H⁺ exchanger 1)是一种定位在液泡膜上的 Ca2+/H+反向转运蛋白,依靠质子动力势将胞质中过量的Ca2+泵入液泡,从而维持钙稳态。2024年,Sheng Luan团队报道,CAX1的活性受到两条信号通路的调控:Ca2+依赖的CBL–CIPK激酶级联通路和Ca2+非依赖的FLS2–BAK1–BIK1/PBL1免疫激酶通路。两者均通过磷酸化CAX1蛋白N端自抑制结构域上的丝氨酸簇来调控其转运活性,从而在植物生长与免疫之间实现 Ca2+信号的平衡(Nature, 2024, https://doi.org/10.1038/s41586-024-07100-0)。
为揭示CAX1的结构基础和调控机制,孙林峰、刘欣和张志勇团队合作开展了系统研究。团队首先建立了基于钙离子荧光探针的活性检测体系,证明CAX1的转运活性受到N端结构域严格控制:在未被磷酸化时,Ca2+运输活性受到抑制;而在磷酸化修饰后,转运活性被激活,在质子浓度梯度的驱动下进行高效Ca2+转运。进一步,团队利用冷冻电镜单颗粒重构技术,解析了CAX1在自抑制状态和模拟磷酸化激活状态下的高分辨率三维结构,揭示了其在磷酸化调控过程中的构象变化。结果显示,CAX1以同源三聚体形式存在,每个单体含11个跨膜螺旋。在自抑制状态下,位于胞质侧的N端结构域如“塞子”般堵住了Ca2+转运通道,阻碍了离子进入;而在模拟磷酸化状态下,N端结构域从转运通道释放,暴露出Ca2+结合位点,激活转运活性。这一结构发现也得到了分子动力学模拟的支持。同时,团队还解析了CAX1与Ca2+的复合物结构,确定了关键的Ca2+识别与转运位点,并通过功能验证和分子动力学模拟进一步证实了其重要性。
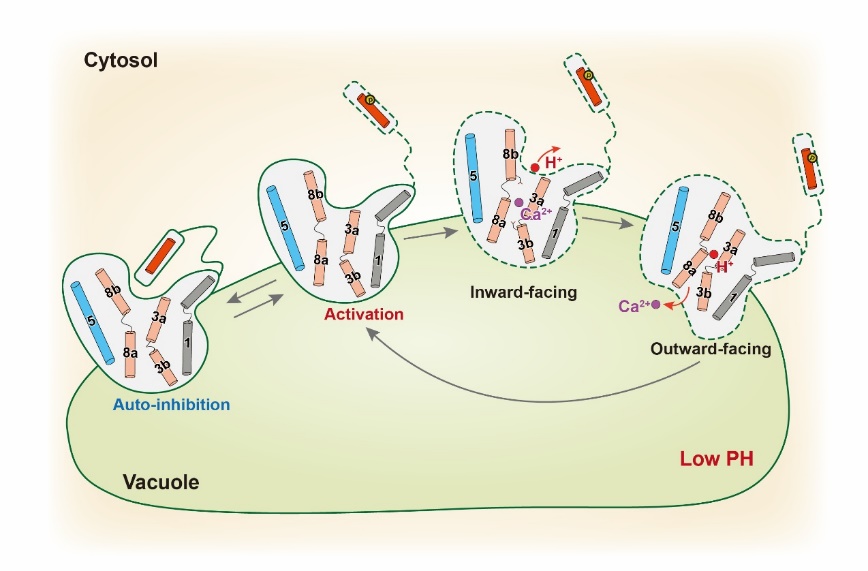
图. CAX1蛋白受磷酸化调控参与钙离子运输的机制示意图。
综上,该研究系统阐释了植物液泡膜Ca2+/H+反向转运蛋白CAX1的自抑制机制及其受磷酸化激活的分子基础,深化了我们对植物如何通过翻译后修饰精细调控钙稳态的理解。鉴于钙稳态与植物的耐盐性、营养利用及抗病性等密切相关,该研究也为作物抗逆改良与分子育种提供了重要理论基础。
中国科学技术大学生命科学与医学部博士研究生王锟和马春慧、物理学院博士研究生陈光临为该论文的并列共同第一作者。中国科学技术大学生命科学与医学部孙林峰教授、刘欣副教授和物理学院张志勇教授为论文的共同通讯作者。中国科学技术大学冷冻电镜中心高永翔博士为冷冻电镜数据采集提供了关键支持。该研究获得了国家自然科学基金、中央高校青年教师科研创新能力支持项目、安徽省自然科学基金、国家重点研发计划、中央高校基本科研业务费、中国科技大学双一流科研基金以及中国博士后科学基金等项目的支持。
(全文链接: https://www.nature.com/articles/s41477-025-02104-8)
