2025年11月12日,中国科学技术大学生命科学与医学部刘欣、孙林峰团队在Nature Structural & Molecular Biology 杂志发表题为“Structural basis of glucose-6-phosphate transport by human SLC37A2”的重要研究成果。该研究系统阐明了人体SLC37A2蛋白跨膜运输葡萄糖-6-磷酸的工作机制。通过解析SLC37A2在无底物和有底物结合状态下的高分辨率冷冻电镜结构,捕获了其转运过程中的不同构象,填补了SLC37家族转运蛋白结构与功能研究方面的空白,为理解相关代谢疾病,特别是糖原贮积症的发病机理提供了重要帮助。
葡萄糖-6-磷酸(G6P)是葡萄糖代谢的核心中间产物。作为糖酵解、糖异生、糖原合成与分解等多条关键生化通路的枢纽,G6P在细胞内的精准转运对维持人体能量与物质代谢平衡至关重要。在糖异生和糖原分解的最后一步,位于细胞质中的G6P需要被转运到内质网中,继而由葡萄糖-6-磷酸酶G6PC水解生成葡萄糖和无机磷酸(Pi)。由于G6P极性较高,无法自由穿过磷脂双分子层,需通过特定转运蛋白(SLC37 /G6PT家族蛋白)的帮助才能实现跨膜运输。SLC37A2属于人体溶质载体SLC37家族,该家族中SLC37A1(也称G6PT2),SLC37A2(G6PT3)和SLC37A4(G6PT1)是主要的G6P转运蛋白。SLC37A2在巨噬细胞中高表达,通过调控代谢过程参与炎症激活,其功能缺陷与动脉粥样硬化、骨代谢异常等一系列严重疾病密切相关。SLC37A4(G6PT1)突变与糖原贮积症Ib型(GSD-Ib)高度相关。此前研究对SLC37家族蛋白的转运机制存在争议,一种观点认为其是依赖Pi浓度梯度进行G6P运输的反向转运蛋白,而另一种观点则支持其作为不依赖Pi梯度的单向转运蛋白。
为了阐释G6P的运输机制,刘欣、孙林峰团队针对SLC37家族蛋白开展了系统的结构与功能研究。团队首先利用HEK293F细胞表达系统成功纯化获得高纯度的SLC37A2和SLC37A4蛋白,并建立了基于放射性标记同位素的体外脂质体转运系统,从而排除了胞内因素的影响。实验证实,SLC37A2和SLC37A4均能有效转运G6P,且其转运活性不依赖跨膜Pi浓度梯度,明确了两者可以作为G6P单向转运蛋白(Uniporter)发挥作用。进一步的分析显示,多种单糖磷酸分子能竞争性抑制SLC37A2对G6P 的转运活性,表明SLC37A2可能具有多种底物选择性,且磷酸基团在底物识别中起到关键作用。
借助冷冻电镜单颗粒重构技术,团队成功解析了SLC37A2在不结合底物的面向内质网腔开放状态,与底物G6P结合的面向细胞质开放状态,以及非对称二聚体状态的三个高分辨率结构。结构显示,SLC37A2以二聚体形式存在,每个单体包含12个跨膜螺旋,采用典型的主要协同转运蛋白超家族(MFS)折叠方式,分为N端和C端两个结构域。G6P结合位点处于两个结构域形成的腔穴中。构象对比揭示了SLC37A2的动态转运机制:在面向细胞质开放状态下,G6P结合于细胞质侧的腔穴中,随着构象变化,N端结构域保持刚性,C端结构域发生大幅度的旋转移动,使底物结合位点从细胞质侧转向内质网腔侧,最终将G6P释放到内质网中。团队通过点突变和转运实验,验证了底物结合位点和构象变化关键残基的功能,并将糖原贮积症Ib型(GSD-Ib)相关的突变位点映射到SLC37A2结构中,发现这些突变主要影响G6P的结合或动态构象转换,从而导致蛋白功能缺陷和疾病的发生。
综上,该研究明确了SLC37A2的G6P单向转运机制,揭示了其底物识别和构象变化的分子基础,为理解SLC37家族转运蛋白的功能提供了帮助。由于SLC37家族蛋白功能异常与多种代谢疾病相关,该研究建立的结构框架为相关疾病的病理机制解析和精准治疗药物开发奠定了重要基础。
中国科学技术大学生命科学与医学部博士研究生赖沁烜和硕士研究生徐梦真为该论文的共同第一作者。中国科学技术大学生命科学与医学部刘欣副教授、孙林峰教授和博士后杨智森(现为安徽医科大学教授)为论文的共同通讯作者。中国科学技术大学冷冻电镜中心高永翔博士为冷冻电镜数据采集提供了关键支持。该研究获得了国家自然科学基金、中央高校青年教师科研创新能力支持项目、合肥综合性国家科学中心前沿交叉科学与生物医学研究所项目、安徽省自然科学基金、中央高校基本科研业务费、中国科技大学双一流科研基金等项目的支持。
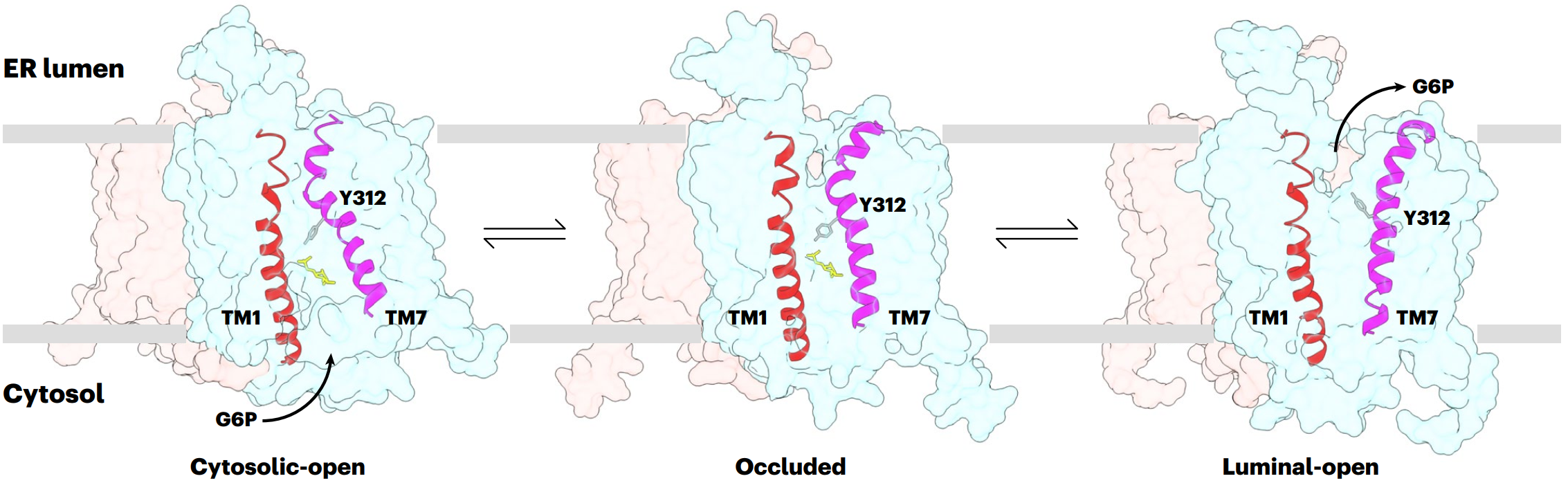
图. SLC37A2转运葡萄糖-6-磷酸(G6P)的机制示意图
全文链接:https://www.nature.com/articles/s41594-025-01712-4
